题目内容
11.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化.下列说法正确的是( )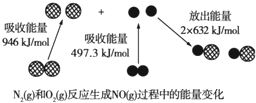
| A. | 通常情况下,NO比N2稳定 | |
| B. | 通常情况下,N2(g)和O2(g)混合能直接反应生成NO | |
| C. | 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的能量 | |
| D. | 1 mol N2(g)和1 mol O2(g)反应放出的能量为179.3 kJ |
分析 A.键能越大,化学键越不容易被打断,化学键越稳定,物质越稳定;
B.氮气和氧气在放电条件才能反应;
C.反应热=反应物总键能-生成物总键能,据此计算反应热,就能量守恒判断;
D.结合C中计算的反应热进行解答.
解答 解:A.氮气分子中氮氮键能大于NO中氮氧键能,故氮气更稳定,故A错误;
B.通常情况下,N2(g)和O2(g)混合不能直接生成NO,需要放电条件,故B错误;
C.反应N2(g)+O2(g)=2NO(g)的反应热△H=946kJ/mol+497.3kJ/mol-2×632kJ/mol=+179.3kJ/mol,反应是吸热反应,依据能量守恒,1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量,故C正确;
D.由C中计算可知,1mol N2(g)和1mol O2(g)反应吸收的能量为179.3kJ,故D错误,
故选C.
点评 本题考查反应热的有关计算,注意理解反应热与物质能量、键能的关系,题目难度中等.

练习册系列答案
相关题目
1.下列四个图象所反映的内容与相应反应符合的是(a、b、c、d均大于0)( )
| A. | 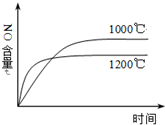 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-a kJ•mol-1 | |
| B. | 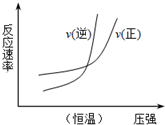 N2(g)+3H2(g)?2NH3(g)△H=+b kJ•mol-1 | |
| C. | 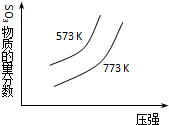 2SO2(g)+O2(g)?2SO3(g)△H=+C kJ•mol-1 | |
| D. | 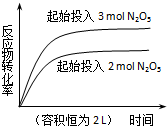 2N2O5(g)?4NO2(g)+O2(g)△H=+d kJ•mol-1 |
2.有如下4种碳架的烃,则下列判断不正确的是( )


| A. | a和d是同分异构体 | B. | b和c是同系物 | ||
| C. | a能发生加成反应 | D. | b和c只能发生取代反应 |
19.有机物分子中的原子(团)之间会相互影响,导致相同的原子(团)表现不同的性质.下列各项的事实不能说明上述观点的是( )
| A. | 乙烯能与溴水发生加成反应,而乙烷不能发生加成反应 | |
| B. | 甲苯能使酸性高锰酸钾溶液褪色,而甲基环己烷不能使酸性高锰酸钾溶液褪色 | |
| C. | 苯酚与溴水可直接反应,而苯与溴水不反应 | |
| D. | 苯酚可以与NaOH反应,而乙醇不能与NaOH反应 |
6. 如图所示的原电池装置,X、Y为两电极,电解质溶液为硫酸铜,外电路中的电子流向如图所示,对此装置的下列说法正确的是( )
如图所示的原电池装置,X、Y为两电极,电解质溶液为硫酸铜,外电路中的电子流向如图所示,对此装置的下列说法正确的是( )
 如图所示的原电池装置,X、Y为两电极,电解质溶液为硫酸铜,外电路中的电子流向如图所示,对此装置的下列说法正确的是( )
如图所示的原电池装置,X、Y为两电极,电解质溶液为硫酸铜,外电路中的电子流向如图所示,对此装置的下列说法正确的是( )| A. | X极上发生的是还原反应,Y极上发生的是氧化反应 | |
| B. | 外电路的电流方向为:X→外电路→Y | |
| C. | 若两电极都是金属,则它们的活动性为X<Y | |
| D. | 若两电极分别为Zn和石墨棒,则Y极质量增重 |
16.将两个铂电极插入KOH溶液中,向两极分别通入H2和O2即可构成氢氧燃料电池.对其有关说法正确的是( )
| A. | 通入氧气的一极为正极,发生氧化反应 | |
| B. | 该电池负极的电极反应为2H2-4e-=4H+ | |
| C. | 该电池工作一段时间,电解质溶液浓度保持不变 | |
| D. | 该电池在工作时,溶液中的阴离子向负极移动 |
20.某澄清透明的溶液中,下列离子组可以大量共存的是( )
| A. | H+、Na+、SO42-、Cu2+ | B. | Ba2+、Mg2+、Cl-、SO42- | ||
| C. | H+、K+、OH-、NO3- | D. | NO3-、I-、H+、Mg2+ |
 ,写出B与浓硝酸反应的化学方程式
,写出B与浓硝酸反应的化学方程式 ,写出B与液溴反应的方程式
,写出B与液溴反应的方程式 .
. .两个氨基乙酸分子在一定条件下能相互作用生成一种二肽,该反应的化学方程式为
.两个氨基乙酸分子在一定条件下能相互作用生成一种二肽,该反应的化学方程式为 .
.