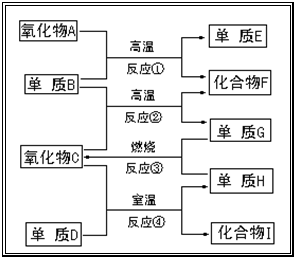
题目内容
5.某溶液中可能含有Ba2+、NH4+、K+、H+、Na+、SO42-、CO32-、HCO3-、Br-等离子中的两种或几种.现进行以下实验:①取上述溶液少量加入过量Ba(NO3)2溶液,产生白色沉淀,过滤,向沉淀中加入过量的硝酸,沉淀完全溶解,并产生气体;
②向实验①的滤液中滴入AgNO3溶液,出现淡黄色沉淀;
③取原溶液与氢氧化钠溶液共热,生成能使湿润红色石蕊试纸变蓝的气体;
④取原溶液进行焰色反应,直接观察,火焰呈黄色.
由以上实验判断,该溶液中肯定存在的离子有NH4+、Na+、CO32-、Br-;肯定不存在的离子为Ba2+、H+、SO42-;不能确定是否存在的离子为K+、HCO3-.
分析 ①取上述溶液少量加入过量Ba(NO3)2溶液,产生白色沉淀,过滤,向沉淀中加入过量的硝酸,沉淀完全溶解,并产生气体,则白色沉淀为碳酸钡,一定不含SO42-;
②向实验①的滤液中滴入AgNO3溶液,出现淡黄色沉淀,沉淀为AgBr,一定含Br-;
③取原溶液与氢氧化钠溶液共热,生成能使湿润红色石蕊试纸变蓝的气体,气体为氨气,一定含NH4+;
④取原溶液进行焰色反应,直接观察,火焰呈黄色,则一定含Na+,再结合离子的反应及离子共存判断.
解答 解:①取上述溶液少量加入过量Ba(NO3)2溶液,产生白色沉淀,过滤,向沉淀中加入过量的硝酸,沉淀完全溶解,并产生气体,则白色沉淀为碳酸钡,一定不含SO42-,则一定含CO32-、可能含HCO3-;由CO32-、Ba2+结合生成沉淀,可知原溶液一定不含Ba2+,由CO32-、H+结合生成水和气体,一定不含H+;
②向实验①的滤液中滴入AgNO3溶液,出现淡黄色沉淀,沉淀为AgBr,一定含Br-;
③取原溶液与氢氧化钠溶液共热,生成能使湿润红色石蕊试纸变蓝的气体,气体为氨气,一定含NH4+;
④取原溶液进行焰色反应,直接观察,火焰呈黄色,则一定含Na+,不能确定是否含K+,
综上所述,该溶液中肯定存在的离子有NH4+、Na+、CO32-、Br-;肯定不存在的离子为Ba2+、H+、SO42-;不能确定是否存在的离子为K+、HCO3-,
故答案为:NH4+、Na+、CO32-、Br-;Ba2+、H+、SO42-;K+、HCO3-.
点评 本题考查无机物的推断及离子反应,为高频考点,把握实验流程中的反应、现象及离子推断为解答的关键,侧重分析与推断能力的考查,注意离子反应及元素化合物知识的综合应用,题目难度不大.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
15.下列有关实验的叙述,正确的是( )
| A. | 用瓷坩埚熔融氢氧化钠或碳酸钠 | |
| B. | 用玻璃棒蘸取溶液,点在湿润的pH试纸上测定溶液的pH值 | |
| C. | 取用金属钠、钾时,未用完的钠、钾应放回原瓶 | |
| D. | 读取量筒内液体的体积,俯视读数会导致读数偏小 |
16.将两个铂电极插入KOH溶液中,向两极分别通入H2和O2即可构成氢氧燃料电池.对其有关说法正确的是( )
| A. | 通入氧气的一极为正极,发生氧化反应 | |
| B. | 该电池负极的电极反应为2H2-4e-=4H+ | |
| C. | 该电池工作一段时间,电解质溶液浓度保持不变 | |
| D. | 该电池在工作时,溶液中的阴离子向负极移动 |
13.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究.
(1)B中反应的离子方程式是Cl2+2OH-═Cl-+ClO-+H2O.
(2)A中溶液变红的原因是Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的,所以溶液变红.
(3)为了探究现象Ⅱ的原因,甲同学进行如下实验.
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在Fe3+.
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液.甲同学的实验证明产生现象Ⅱ的原因是SCN-与Cl2发生了反应.
(4)甲同学猜想SCN-可能被Cl2氧化了,他又进行了如下研究.资料显示:SCN-的电子式为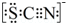 .
.
①甲同学认为SCN-中碳元素没有被氧化,理由是SCN-中的碳元素是最高价态+4价.
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,此证明SCN-中被氧化的元素是硫元素.
③通过实验证明了SCN-中氮元素转化为NO3-,他的实验方案是取足量铜粉于试管中,加入A中黄色溶液和一定量的稀盐酸,加热,观察到试管上方有红棕色气体生成,证明A中存在,SCN-中氮元素被氧化成.
④若SCN-与Cl2反应生成1mol CO2,写出反应离子方程式SCN-+8Cl2+9H2O=NO3-+SO42-+CO2+Cl-+18H+,并计算转移电子的物质的量是16mol.
| 操 作 | 现 象 |
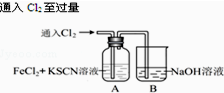 | I.A中溶液变红 Ⅱ.稍后,溶液由红色变为黄色 |
(2)A中溶液变红的原因是Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的,所以溶液变红.
(3)为了探究现象Ⅱ的原因,甲同学进行如下实验.
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在Fe3+.
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液.甲同学的实验证明产生现象Ⅱ的原因是SCN-与Cl2发生了反应.
(4)甲同学猜想SCN-可能被Cl2氧化了,他又进行了如下研究.资料显示:SCN-的电子式为
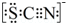 .
.①甲同学认为SCN-中碳元素没有被氧化,理由是SCN-中的碳元素是最高价态+4价.
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,此证明SCN-中被氧化的元素是硫元素.
③通过实验证明了SCN-中氮元素转化为NO3-,他的实验方案是取足量铜粉于试管中,加入A中黄色溶液和一定量的稀盐酸,加热,观察到试管上方有红棕色气体生成,证明A中存在,SCN-中氮元素被氧化成.
④若SCN-与Cl2反应生成1mol CO2,写出反应离子方程式SCN-+8Cl2+9H2O=NO3-+SO42-+CO2+Cl-+18H+,并计算转移电子的物质的量是16mol.
20.某澄清透明的溶液中,下列离子组可以大量共存的是( )
| A. | H+、Na+、SO42-、Cu2+ | B. | Ba2+、Mg2+、Cl-、SO42- | ||
| C. | H+、K+、OH-、NO3- | D. | NO3-、I-、H+、Mg2+ |
10.某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+.取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀.由此可知原溶液中( )
| A. | Cl-一定存在,且c(Cl-)≥0.4 mol/L | |
| B. | SO42-、NH4+一定存在,Cl-可能不存在 | |
| C. | CO32-、Al3+一定不存在,K+可能存在 | |
| D. | 至少存在5种离子 |
17.下列实验装置正确且能达到实验目的是( )


| A. | 用图1所示装置制取少量Cl2 | |
| B. | 用图2所示装置证明非金属性Cl>C>Si | |
| C. | 图3所示装置中水不能持续流下,说明装置气密性良好 | |
| D. | 用图4所示装置测定镁铝合金中铝的质量分数 |
14.下列能与文字表述对应且正确的反应方程式是( )
| A. | 甲烷和氯气在光照条件下反应:2CH4+Cl2$\stackrel{光照}{→}$2CH3 Cl+H2 | |
| B. | 实验室用电石制乙炔:CaC2+2H2O→Ca(OH)2+HC≡CH↑ | |
| C. | 用NaOH溶液中和苯酚溶液的酸性:H++OH-═H2O | |
| D. | 向苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2 C6H5OH+CO32- |