题目内容
4.如图是某化学反应过程中能量变化的曲线图.下列有关叙述正确的是( )
| A. | 该反应为吸热反应 | |
| B. | 该图可以表示Ba(OH)2•8H2O与NH4Cl的反应 | |
| C. | 化学反应中的能量变化只表现为热量的变化 | |
| D. | 化学反应中有旧键断裂就一定有新键形成 |
分析 A、该反应中反应物的总能量大于生成物的总能量;
B、Ba(OH)2•8H2O与NH4Cl的反应为吸热反应;
C、化学反应中的能量变化可以表现为热能的变化、光能的变化等;
D、化学反应的实质是旧键的断裂和新键的形成.
解答 解:A、该反应中反应物的总能量大于生成物的总能量,故为放热反应,故A错误;
B、Ba(OH)2•8H2O与NH4Cl的反应为吸热反应,而此反应为放热反应,故该图不能表示Ba(OH)2•8H2O与NH4Cl的反应,故B错误;
C、化学反应中的能量变化可以表现为热能的变化、光能、电能的变化等,不只是能表现为热量的变化,故C错误;
D、化学反应的实质是旧键的断裂和新键的形成,故化学反应中当有旧键断裂时,一定有新键的形成,故D正确.
故选D.
点评 本题考查了化学反应的实质和反应中的能量变化,难度不大,应注意的是化学反应中一定有化学键的断裂,但有化学键的断裂时不一定是化学反应.

练习册系列答案
相关题目
14.下列有关物质的性质与其应用不相对应的是( )
| A. | Al具有良好延展性和抗腐蚀性,可制成铝箔包装物品 | |
| B. | NaHCO3能与碱反应,食品工业用作焙制糕点的膨松剂 | |
| C. | 药皂中加入少量苯酚,可以起到杀菌消毒的作用 | |
| D. | 明矾能水解生成Al(OH)3胶体,可用作净水剂 |
15.下列有关实验的叙述,正确的是( )
| A. | 用瓷坩埚熔融氢氧化钠或碳酸钠 | |
| B. | 用玻璃棒蘸取溶液,点在湿润的pH试纸上测定溶液的pH值 | |
| C. | 取用金属钠、钾时,未用完的钠、钾应放回原瓶 | |
| D. | 读取量筒内液体的体积,俯视读数会导致读数偏小 |
12.如表列出了前20号元素中的某些元素性质的一些数据:
(1)以上10种元素中,电负性最大的是O(填元素符号).
(2)写出下列有关反应的化学方程式:
①E的单质与I元素的最高价氧化物对应的水化物反应:C+4HNO3(浓)=CO2↑+4NO2↑+2H2O.
②B2C2与EC2反应:2K2O2+2CO2=2K2CO3+O2.
(3)A元素原子核外电子排布图是1s22s22p63s23p4;比元素B原子序数大11的元素的原子的电子排布式是1s22s22p63s23p63d104s2或者[Ar]3d104s2.
(4)C和I相比较,非金属性较弱的是氮(填元素名称).
| 元素 性质 | A | B | C | D | E | F | G | H | I | J |
| 原子半径(10-10 m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高 价态 | +6 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低 价态 | -2 | - | -2 | - | -4 | -3 | -1 | - | -3 | -4 |
(2)写出下列有关反应的化学方程式:
①E的单质与I元素的最高价氧化物对应的水化物反应:C+4HNO3(浓)=CO2↑+4NO2↑+2H2O.
②B2C2与EC2反应:2K2O2+2CO2=2K2CO3+O2.
(3)A元素原子核外电子排布图是1s22s22p63s23p4;比元素B原子序数大11的元素的原子的电子排布式是1s22s22p63s23p63d104s2或者[Ar]3d104s2.
(4)C和I相比较,非金属性较弱的是氮(填元素名称).
19.有机物分子中的原子(团)之间会相互影响,导致相同的原子(团)表现不同的性质.下列各项的事实不能说明上述观点的是( )
| A. | 乙烯能与溴水发生加成反应,而乙烷不能发生加成反应 | |
| B. | 甲苯能使酸性高锰酸钾溶液褪色,而甲基环己烷不能使酸性高锰酸钾溶液褪色 | |
| C. | 苯酚与溴水可直接反应,而苯与溴水不反应 | |
| D. | 苯酚可以与NaOH反应,而乙醇不能与NaOH反应 |
9.下列物质的转化在给定条件下能实现的是( )
| A. | S$\stackrel{O_{2}点燃}{→}$ SO3$\stackrel{足量氨水}{→}$(NH4)2SO4 | |
| B. | NH3$→_{加热}^{O_{2}/催化剂}$NO$\stackrel{O_{2}}{→}$ NO2 | |
| C. | Fe$→_{加热}^{少量Cl_{2}}$ FeCl2$→_{溶液}^{NaOH溶液}$Fe(OH)2 | |
| D. | Al$→_{溶液}^{NaOH溶液}$ NaAlO2$\stackrel{足量盐酸}{→}$Al(OH)3 |
16.将两个铂电极插入KOH溶液中,向两极分别通入H2和O2即可构成氢氧燃料电池.对其有关说法正确的是( )
| A. | 通入氧气的一极为正极,发生氧化反应 | |
| B. | 该电池负极的电极反应为2H2-4e-=4H+ | |
| C. | 该电池工作一段时间,电解质溶液浓度保持不变 | |
| D. | 该电池在工作时,溶液中的阴离子向负极移动 |
13.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究.
(1)B中反应的离子方程式是Cl2+2OH-═Cl-+ClO-+H2O.
(2)A中溶液变红的原因是Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的,所以溶液变红.
(3)为了探究现象Ⅱ的原因,甲同学进行如下实验.
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在Fe3+.
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液.甲同学的实验证明产生现象Ⅱ的原因是SCN-与Cl2发生了反应.
(4)甲同学猜想SCN-可能被Cl2氧化了,他又进行了如下研究.资料显示:SCN-的电子式为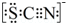 .
.
①甲同学认为SCN-中碳元素没有被氧化,理由是SCN-中的碳元素是最高价态+4价.
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,此证明SCN-中被氧化的元素是硫元素.
③通过实验证明了SCN-中氮元素转化为NO3-,他的实验方案是取足量铜粉于试管中,加入A中黄色溶液和一定量的稀盐酸,加热,观察到试管上方有红棕色气体生成,证明A中存在,SCN-中氮元素被氧化成.
④若SCN-与Cl2反应生成1mol CO2,写出反应离子方程式SCN-+8Cl2+9H2O=NO3-+SO42-+CO2+Cl-+18H+,并计算转移电子的物质的量是16mol.
| 操 作 | 现 象 |
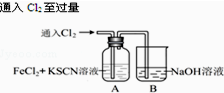 | I.A中溶液变红 Ⅱ.稍后,溶液由红色变为黄色 |
(2)A中溶液变红的原因是Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的,所以溶液变红.
(3)为了探究现象Ⅱ的原因,甲同学进行如下实验.
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在Fe3+.
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液.甲同学的实验证明产生现象Ⅱ的原因是SCN-与Cl2发生了反应.
(4)甲同学猜想SCN-可能被Cl2氧化了,他又进行了如下研究.资料显示:SCN-的电子式为
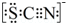 .
.①甲同学认为SCN-中碳元素没有被氧化,理由是SCN-中的碳元素是最高价态+4价.
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,此证明SCN-中被氧化的元素是硫元素.
③通过实验证明了SCN-中氮元素转化为NO3-,他的实验方案是取足量铜粉于试管中,加入A中黄色溶液和一定量的稀盐酸,加热,观察到试管上方有红棕色气体生成,证明A中存在,SCN-中氮元素被氧化成.
④若SCN-与Cl2反应生成1mol CO2,写出反应离子方程式SCN-+8Cl2+9H2O=NO3-+SO42-+CO2+Cl-+18H+,并计算转移电子的物质的量是16mol.
14.下列能与文字表述对应且正确的反应方程式是( )
| A. | 甲烷和氯气在光照条件下反应:2CH4+Cl2$\stackrel{光照}{→}$2CH3 Cl+H2 | |
| B. | 实验室用电石制乙炔:CaC2+2H2O→Ca(OH)2+HC≡CH↑ | |
| C. | 用NaOH溶液中和苯酚溶液的酸性:H++OH-═H2O | |
| D. | 向苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2 C6H5OH+CO32- |