题目内容
13.下列有关物质用途的说法中,不正确的是( )| A. | Fe2O3常用作红色油漆和涂料 | B. | 碳酸氢钠可用于治疗胃酸过多 | ||
| C. | 二氧化硅可用于制造集成电路 | D. | Cl2可用于制漂白粉 |
分析 A.Fe2O3为红色物质,难溶于水;
B.胃酸主要成分是盐酸,碳酸氢钠腐蚀性较小,和盐酸反应;
C.二氧化硅为绝缘体,是光导纤维的成分,集成电路利用的是单质硅的性质;
D.氯气和氢氧化钙之间反应可以得到漂白粉,
解答 解:A.Fe2O3为红色物质,不溶于水则常用作红色油漆和涂料,故A正确;
B.胃酸主要成分是盐酸,所以碳酸氢钠可用于治疗胃酸过多的反应物是碳酸氢钠和盐酸,生成物是氯化钠、水、二氧化碳,方程式是:NaHCO3+HCl═NaCl+H2O+CO2↑,故B正确;
C.二氧化硅为绝缘体,不导电,晶体硅是良好的半导体材料可用于制造集成电路,故C错误;
D.工业上将Cl2通入石灰乳制取漂白粉,反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.故D正确;
故选C.
点评 本题考查了物质性质和应用,主要是铁、钠、硅、氯及其化合物性质,注意知识积累,题目较简单.

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
3.氧化剂H2O2在反应时不产生污染物被称为绿色氧化剂,因而受到人们越来越多的关注.
I.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如表所示的方案完成实验.
(1)实验①和②的目的是探究浓度对反应速率的影响.
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1所示.

分析该图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
Ⅱ.资料显示,某些金属离子对H2O2的分解起催化作用.为探究不同浓度的Fe3+对H2O2分解的催化效果,实验小组的同学设计了如图2所示的实验装置进行实验.
限选试剂:30% H2O2、0.1mol?L-1Fe2(SO4)3、蒸馏水
(3)某同学通过测定O2的体积来比较H2O2的分解速率快慢.实验时可以通过测量相同时间内产生O2的体积(产生相同体积氧气所需的时间)来比较.(要求所测得的数据能直接体现反应速率大小).
(4)参照如表格式,拟定实验表格,完整体现上述实验的方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示).
I.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如表所示的方案完成实验.
| 实验编号 | 反应物 | 加入物质 |
| ① | 10mL 2% H2O2溶液 | 无 |
| ② | 10mL 5% H2O2溶液 | 无 |
| ③ | 9mL 5% H2O2溶液 | 1mL 水 |
| ④ | 9mL 5% H2O2溶液 | 1mL 0.1mol•L-1 HCl溶液 |
| ⑤ | 9mL 5% H2O2溶液 | 1mL 0.1mol•L-1 NaOH溶液 |
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1所示.

分析该图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
Ⅱ.资料显示,某些金属离子对H2O2的分解起催化作用.为探究不同浓度的Fe3+对H2O2分解的催化效果,实验小组的同学设计了如图2所示的实验装置进行实验.
限选试剂:30% H2O2、0.1mol?L-1Fe2(SO4)3、蒸馏水
(3)某同学通过测定O2的体积来比较H2O2的分解速率快慢.实验时可以通过测量相同时间内产生O2的体积(产生相同体积氧气所需的时间)来比较.(要求所测得的数据能直接体现反应速率大小).
(4)参照如表格式,拟定实验表格,完整体现上述实验的方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示).
| 物理量 实验序号 | V[30% H2O2]/mL | … | |
| 1 | a | … | |
| 2 | a | … |
4.有关如图所示原电池(盐桥中装有含琼胶的KCl饱和溶液)的叙述,正确的是( )
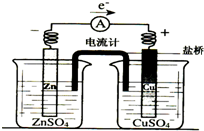

| A. | 铜片上有气泡逸出 | |
| B. | 取出盐桥后,电流计依然发生偏转 | |
| C. | 反应中,盐桥中的K+会移向CuSO4溶液 | |
| D. | 铜片上发生氧化反应 |
1.下列说法全不正确的是( )
①CH3-CH=CH2和CH2=CH2的最简式相同
②CH≡CH和C6H6含碳量相同
③丁二烯和丁烯为同系物
④正戊烷、异戊烷、新戊烷的沸点逐渐变低
⑤能够快速、微量、精确的测定相对分子质量的物理方法是核磁共振谱法.
①CH3-CH=CH2和CH2=CH2的最简式相同
②CH≡CH和C6H6含碳量相同
③丁二烯和丁烯为同系物
④正戊烷、异戊烷、新戊烷的沸点逐渐变低
⑤能够快速、微量、精确的测定相对分子质量的物理方法是核磁共振谱法.
| A. | ①② | B. | ③④ | C. | ②③ | D. | ③⑤ |
8.含有一个双键的烯烃,和氢气加成后的产物结构简式如图,则此烃可能有的结构有( )


| A. | 4 种 | B. | 5 种 | C. | 7 种 | D. | 9 种 |
18.著名丹麦物理学家尼•玻尔(N.Bohr)将他钟爱的金制诺贝尔奖章用王水溶解成“金溶液”,化学方程式可简单表示为:Au+NHO3+3HCl═AuCl3+NO↑+2H2O,AuCl3+HCl═HAuCl4(四氯合金酸).纳粹分子对这种溶液“愚笨”得视而不见、毫无所知.战争结束后,物理学家又根据以下反应,炼出黄金并铸出更加灿烂夺目的奖章:2HAuCl4@2HCl↑+3Cl2↑+2Au.表现出伟大科学家对祖国的无比热爱和非凡智慧.下列叙述中正确的是( )
| A. | 王水能溶解黄金,但不能溶解白金 | |
| B. | HAuCl4具有很强的氧化性 | |
| C. | 盐酸有很强的还原性 | |
| D. | 浓盐酸和浓硝酸按照体积比1:3能配成王水 |
5.如果慢慢把下列溶液加热蒸干并灼烧,可以得到该溶液溶质固体的是( )
| A. | 高锰酸钾 | B. | 亚硫酸钠 | C. | 氯化铁 | D. | 碳酸钾 |
3.下列各化合物的命名中正确的是( )
| A. | CH2═CH-CH═CH2 1,3-二丁烯 | B. | CH3-CH2-CH═CH2 3-丁烯 | ||
| C. |  对二甲苯 对二甲苯 | D. |  3-甲基丁烷 3-甲基丁烷 |
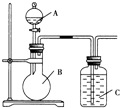 某甲同学设计如图装置,比较非金属元素的非金属性强弱.请按要求回答下列问题:
某甲同学设计如图装置,比较非金属元素的非金属性强弱.请按要求回答下列问题: