��Ŀ����
��10�֣���һ�ݻ�Ϊ2 L���ܱ������У�����0.2 mol��N2��0.6 mol��H2����һ�������·�����Ӧ��N2(g)��3H2(g) 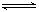 2NH3(g) ��H��0��Ӧ��NH3�����ʵ���Ũ�ȵı仯�������ͼ��ʾ����ش��������⣺
2NH3(g) ��H��0��Ӧ��NH3�����ʵ���Ũ�ȵı仯�������ͼ��ʾ����ش��������⣺
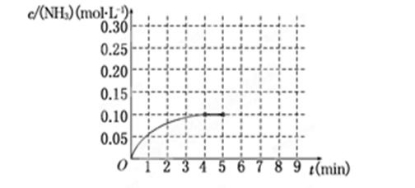
��1��������ͼ������ӷ�Ӧ��ʼ��ƽ��ʱ��ƽ�ⷴӦ����v(NH3)Ϊ__________��
��2���÷�Ӧ�ﵽƽ��ʱH2��ת����Ϊ________��
��3����Ӧ�ﵽƽ���5����ĩ�����������������䣬���ı䷴Ӧ�¶ȣ���NH3�����ʵ���Ũ�Ȳ�����Ϊ________��(�����)
a��0.20 mol��L��1 b��0.12 mol��L��1
c��0.10 mol��L��1 d��0.08 mol��L��1
��4����д���÷�Ӧ��ƽ�ⳣ������ʽ___ ______�����÷�Ӧ��298K��398Kʱ�Ļ�ѧƽ�ⳣ���ֱ�ΪK1��K2����K1 K2���������=�� �� ������ ����
��5���ڵ�5����ĩ�������������Сһ������ڵ�8����ĩ�ﵽ�µ�ƽ��(��ʱNH3��Ũ��ԼΪ0.25mol��L��1)��������ͼ�л�����5����ĩ����ƽ��ʱNH3Ũ�ȵı仯���ߣ�
��1��0.025mol/(l.min) ��2��50% ��3��a��c ��4�� ��>
��>
��5��

��������
�����������1����ͼ��֪��4min��ƽ�⣬��c��NH3��=0.1mol/L��v��NH3��= =0.025mol/��L?min�����ʴ�Ϊ��0.025mol/��L?min������2����N2��g��+3H2��g��?2NH3��g����֪�����ɰ���0.2molʱ�μӷ�Ӧ������Ϊ0.3mol������������ת����Ϊ
=0.025mol/��L?min�����ʴ�Ϊ��0.025mol/��L?min������2����N2��g��+3H2��g��?2NH3��g����֪�����ɰ���0.2molʱ�μӷ�Ӧ������Ϊ0.3mol������������ת����Ϊ ��100%=50%����3����H��0���÷�ӦΪ���ȷ�Ӧ�������¶������ƶ�����Ũ�ȼ�С�������¶ȣ������ƶ���Ũ��������Ӧ�ﲻ����ȫ��Ӧ������0��c��NH3����0.2mol/L����NH3�����ʵ���Ũ�Ȳ�����Ϊ0.2mol/L�����ǣ��ı��¶�ƽ��һ���ƶ���NH3�����ʵ���Ũ��Ҳ������Ϊ0.1mol/L���ʴ�Ϊ��a��c��
��100%=50%����3����H��0���÷�ӦΪ���ȷ�Ӧ�������¶������ƶ�����Ũ�ȼ�С�������¶ȣ������ƶ���Ũ��������Ӧ�ﲻ����ȫ��Ӧ������0��c��NH3����0.2mol/L����NH3�����ʵ���Ũ�Ȳ�����Ϊ0.2mol/L�����ǣ��ı��¶�ƽ��һ���ƶ���NH3�����ʵ���Ũ��Ҳ������Ϊ0.1mol/L���ʴ�Ϊ��a��c��
��4��ƽ�ⳣ��Ϊ������Ũ����֮���뷴Ӧ��Ũ����֮���ıȣ���K= ���÷�ӦΪ���ȷ�Ӧ���¶�Խ��ƽ�ⳣ��ԽС����Ӧ��298K��398Kʱ�Ļ�ѧƽ�ⳣ���ֱ�ΪK1��K2������K1��K2����5����5����ĩ�������������Сһ���ѹǿ����ƽ�������ƶ���������Ũ�������ڵ�8����ĩ�ﵽ�µ�ƽ��ʱNH3��Ũ��ԼΪ0.25mol?L-1����ͼ��Ϊ��
���÷�ӦΪ���ȷ�Ӧ���¶�Խ��ƽ�ⳣ��ԽС����Ӧ��298K��398Kʱ�Ļ�ѧƽ�ⳣ���ֱ�ΪK1��K2������K1��K2����5����5����ĩ�������������Сһ���ѹǿ����ƽ�������ƶ���������Ũ�������ڵ�8����ĩ�ﵽ�µ�ƽ��ʱNH3��Ũ��ԼΪ0.25mol?L-1����ͼ��Ϊ��
 ��
��
���㣺��ѧƽ��ļ���

 N2O4(g)���ﵽƽ�������������ڳ���a mol NO2����ƽ�����ԭƽ��Ƚϴ������
N2O4(g)���ﵽƽ�������������ڳ���a mol NO2����ƽ�����ԭƽ��Ƚϴ������  2C��g���ﵽƽ��ʱ��A��B��C�����ʵ����ֱ�Ϊ4 mol��2 mol��4 mol�������¶Ⱥ�ѹǿ���䣬��ƽ�����������ߵ����ʵ��������µ�������ʹƽ�����Ƶ���
2C��g���ﵽƽ��ʱ��A��B��C�����ʵ����ֱ�Ϊ4 mol��2 mol��4 mol�������¶Ⱥ�ѹǿ���䣬��ƽ�����������ߵ����ʵ��������µ�������ʹƽ�����Ƶ���