题目内容
(16分)(1)写出下列物质在水溶液中电离的方程式
HNO3 HClO
NaHCO3
(2)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为___________________________________________。
(3)己知:①H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
②H2(g)+1/2O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
③C(s)+1/2O2(g)=CO(g) ΔH=-110.5 kJ·mol-1
④C(s)+ O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
回答下列问题:
①上述反应中属于放热反应的是_________________。
②H2的燃烧热为_______________,C的燃烧热为__________________.
③燃烧l0gH2 生成液态水,放出的热量为_________________.
④CO的燃烧热为___________,其热化学方程式为_____________ __________.
(1)HNO3=H++NO3- HClO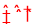 H++ClO- NaHCO3=Na++HCO3- HCO3-
H++ClO- NaHCO3=Na++HCO3- HCO3-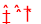 H++CO32-
H++CO32-
(2)CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) ΔH= -725.76 kJ·mol-1 (3)①: ①②③④
②285.8 kJ·mol-1 393.5 kJ·mol-1 ③1429 kJ ④283 kJ·mol-1 CO(g)+1/2O2(g)=CO2(g) ΔH= -283 kJ·mol-1
【解析】
试题解析:(1)HNO3为强电解质,完全电离,电离方程式为HNO3=H++NO3- , HClO为一元弱酸不完全电离,电离方程式为HClO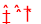 H++ClO-,NaHCO3为强电解质,完全电离,电离方程式为NaHCO3=Na++HCO3- HCO3-
H++ClO-,NaHCO3为强电解质,完全电离,电离方程式为NaHCO3=Na++HCO3- HCO3-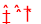 H++CO32-;(2)1g甲醇燃烧生成CO2和液态水时放热22.68kJ,1mol甲醇完全燃烧生成二氧化碳和液态水放热22.68kJ×32=725.8KJ,燃烧热热化学方程式为:CH3OH(l)+
H++CO32-;(2)1g甲醇燃烧生成CO2和液态水时放热22.68kJ,1mol甲醇完全燃烧生成二氧化碳和液态水放热22.68kJ×32=725.8KJ,燃烧热热化学方程式为:CH3OH(l)+ O2(g)═CO2(g)+2H2O(l)△H=-725.76 kJ?mol-1,(3)①热化学方程式中△H为负值的反应为放热反应,△H为正值的为吸热反应,①H2(g)+
O2(g)═CO2(g)+2H2O(l)△H=-725.76 kJ?mol-1,(3)①热化学方程式中△H为负值的反应为放热反应,△H为正值的为吸热反应,①H2(g)+ O2(g)═H2O(l)△H=-285.8kJ/mol ②H2(g)+
O2(g)═H2O(l)△H=-285.8kJ/mol ②H2(g)+ O2(g)═H2O(g)△H=-241.8kJ/mol
O2(g)═H2O(g)△H=-241.8kJ/mol
③C(s)+ O2(g)═CO(g)△H=-110.5kJ/mol ④C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
O2(g)═CO(g)△H=-110.5kJ/mol ④C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
以上4个反应均为放热反应;②1mol纯净物完全燃烧生成稳定的氧化物所放出的热量为燃烧热,则H2的燃烧热为285.8 kJ·mol-1,C的燃烧热为393.5 kJ·mol-1 ;③烧l0gH2生成液态水,放出的热量为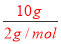 ×285.8 kJ·mol-1=1429 kJ;④C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol,把方程式④-③得:CO(g)+
×285.8 kJ·mol-1=1429 kJ;④C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol,把方程式④-③得:CO(g)+ O2(g)=CO2 (g)△H=-283.0kJ/mol,CO的燃烧热为283.0kJ/mol。
O2(g)=CO2 (g)△H=-283.0kJ/mol,CO的燃烧热为283.0kJ/mol。
考点:有关反应热的计算

 初中学业考试导与练系列答案
初中学业考试导与练系列答案 2NH3(g) ΔH<0反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
2NH3(g) ΔH<0反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题: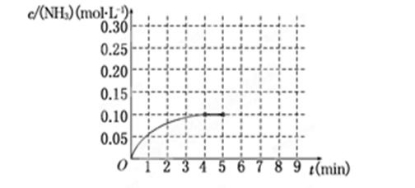
 CH3COO-+H+对于该平衡,下列叙述正确的是
CH3COO-+H+对于该平衡,下列叙述正确的是