题目内容
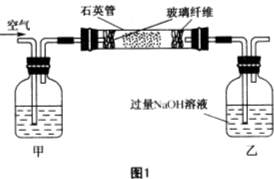 黄铁矿(主要成分为FeS2,含少量其他金属硫化物)曾是我国一些硫酸厂制取硫酸够主要原料.某化学学习小组对黄铁矿石进行如下实验探究:
黄铁矿(主要成分为FeS2,含少量其他金属硫化物)曾是我国一些硫酸厂制取硫酸够主要原料.某化学学习小组对黄铁矿石进行如下实验探究:【实验一】测定硫元素的含量.
I.将m1g黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,往甲瓶中不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全.石英管中主要发生反应的化学方程式为
4FeS2+11O2
| ||
Ⅱ.反应结束后,将乙瓶中的溶液按图2的流程进行处理(H2O2可以氧化亚硫酸钠).
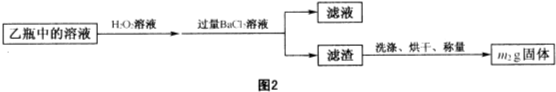
【实验二】测定铁元素的含量.
Ⅲ.测定铁元素含量的实验步骤如图3所示(假设其他金属元素不影响铁元素的测定;MnO
- 4 |
Fe2+氧化成Fe3+,并被还原为Mn2+).
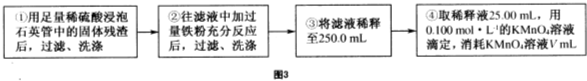
问题讨论:
(1)图1装置中,甲瓶内所盛试剂是
(2)图2流程中除了可以用H2O2溶液作为氧化剂,还可用
①氯水 ②浓硫酸 ③HNO3 ④Fe2(SO4)3
(3)该黄铁矿中硫元素的质量分数为
(4)写出在酸性溶液中,KMnO4与Fe2+反应的离子方程式
(5)列式计算黄铁矿样品中铁元素的质量(没有计算过程;计算结果正确也不给分).
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)空气中含有二氧化碳,能和乙中的氢氧化钠反应生成碳酸钠,碳酸钠和氯化钡反应生成碳酸钡导致沉淀量增大,从而导致干扰硫元素的测定,所以要把空气中二氧化碳除去,用氢氧化钠或氢氧化钾溶液除去即可;
(2)图2流程目的是将+2价铁氧化为+3价铁,应选择氧化性较强的氧化剂;
(3)分析最终产物,根据S元素守恒计算;
(4)亚铁离子有还原性,酸性条件下高锰酸根离子有强氧化性,所以能发生氧化还原反应生成锰离子、铁离子和水,据此写出离子方程式;
(5)根据铁元素守恒计算得出.
(2)图2流程目的是将+2价铁氧化为+3价铁,应选择氧化性较强的氧化剂;
(3)分析最终产物,根据S元素守恒计算;
(4)亚铁离子有还原性,酸性条件下高锰酸根离子有强氧化性,所以能发生氧化还原反应生成锰离子、铁离子和水,据此写出离子方程式;
(5)根据铁元素守恒计算得出.
解答:
解:(1)空气中含有二氧化碳,能和乙中的氢氧化钠反应生成碳酸钠,碳酸钠和氯化钡反应生成碳酸钡导致沉淀量增大,从而导致干扰硫元素的测定,所以要把空气中二氧化碳除去,用氢氧化钠或氢氧化钾溶液除去即可,所以甲中盛放的是氢氧化钠溶液或氢氧化钾溶液,故答案为:NaOH或KOH;
(2)图2流程目的是将+2价铁氧化为+3价铁,应选择氧化性较强的氧化剂,氯水和HNO3都能氧化亚铁离子,故答案为:①③;
(3)最终所得沉淀是硫酸钡,根据硫原子守恒得硫的质量,设硫的质量为x,
S~BaSO4
32g 233g
x m2g
x=
,质量分数=
×100%=
×100%,故答案为:
×100%;
(4)亚铁离子有还原性,酸性条件下高锰酸根离子有强氧化性,所以能发生氧化还原反应生成锰离子、铁离子和水,离子方程式为5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O;Fe2+离子与酸性高锰酸钾反应的离子方程式为:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O,故答案为:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
(5)滤液中含Fe2+物质的量为:n(Fe2+)=5×0.100mol?L-1×V×10-3L=5.00×10-4Vmol,样品中含铁元素:n(Fe)=10×
×5.00×10-4Vmol=
×10-2Vmol,样品中铁元素的质量:m(Fe)=56g?mol-1×
×10-2Vmol=0.187Vg,故答案为:0.187Vg.
(2)图2流程目的是将+2价铁氧化为+3价铁,应选择氧化性较强的氧化剂,氯水和HNO3都能氧化亚铁离子,故答案为:①③;
(3)最终所得沉淀是硫酸钡,根据硫原子守恒得硫的质量,设硫的质量为x,
S~BaSO4
32g 233g
x m2g
x=
| 32m2 |
| 233 |
| ||
| m1 |
| 32m2 |
| 233m1 |
| 32m2 |
| 233m1 |
(4)亚铁离子有还原性,酸性条件下高锰酸根离子有强氧化性,所以能发生氧化还原反应生成锰离子、铁离子和水,离子方程式为5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O;Fe2+离子与酸性高锰酸钾反应的离子方程式为:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O,故答案为:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
(5)滤液中含Fe2+物质的量为:n(Fe2+)=5×0.100mol?L-1×V×10-3L=5.00×10-4Vmol,样品中含铁元素:n(Fe)=10×
| 2 |
| 3 |
| 1 |
| 3 |
| 1 |
| 3 |
点评:考查物质组成与含量的测定、对实验原理理解、氧化还原滴定、阅读获取信息的能力等,难度较大,是对知识的综合运用,理解实验原理是解题的关键,需要学生具有扎实的基础与综合运用分析解决问题的能力,质量分数计算量较大、步骤较多,是易错点..

练习册系列答案
相关题目
用物质的量都是0.1mol的HCN和NaCN配成1L混合溶液,已知其中c(CN-)小于c(Na+),则下列判断正确的是( )
| A、c(H+)>c(OH-) |
| B、c(HCN)>c(CN-) |
| C、c(HCN)>c(CN-)=0.2 mol?L-1 |
| D、c(CN-)>c(OH-)=0.1 mol?L-1 |
下列分子的结构中,原子的最外层电子不都满足8e-稳定结构的是( )
| A、CO2 |
| B、PCl3 |
| C、CCl4 |
| D、BF3 |
同条件等体积等pH的醋酸和盐酸分别加水稀释后,溶液的pH仍相同,则所得溶液的体积( )
| A、仍相同 | B、醋酸大 |
| C、盐酸大 | D、无法判断 |


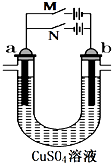 第一阶段:合上M断开N,a极上产224mL(标准状况,下同)气体,b极上有金属析出;
第一阶段:合上M断开N,a极上产224mL(标准状况,下同)气体,b极上有金属析出; 表格中的各种情况,可以用如图的曲线表示的是( )
表格中的各种情况,可以用如图的曲线表示的是( )