题目内容
用物质的量都是0.1mol的HCN和NaCN配成1L混合溶液,已知其中c(CN-)小于c(Na+),则下列判断正确的是( )
| A、c(H+)>c(OH-) |
| B、c(HCN)>c(CN-) |
| C、c(HCN)>c(CN-)=0.2 mol?L-1 |
| D、c(CN-)>c(OH-)=0.1 mol?L-1 |
考点:离子浓度大小的比较
专题:
分析:物质的量都是0.1mol的HCN和NaCN配成1L混合溶液,已知其中c(CN-)小于c(Na+),根据溶液电中性的原则,溶液中存在c(CN-)+c(OH-)=c(Na+)+c(H+),则有c(H+)<c(OH-),溶液应呈碱性,结合电荷守恒、物料守恒等知识解答该题.
解答:
解:A.已知其中c(CN-)小于c(Na+),根据溶液电中性的原则,溶液中存在c(CN-)+c(OH-)=c(Na+)+c(H+),则有c(H+)<c(OH-),故A错误;
B.溶液中c(CN-)小于c(Na+),则说明混合溶液中以CN-的水解程度大于HCN的电离程度,所以c(HCN)>c(CN-),故B正确;
C.HCN和NaCN的物质的量都为0.1mol,由物料守恒可知c(CN-)+c(HCN)=0.2mol/L,故C错误;
D.溶液中存在c(CN-)+c(OH-)=c(Na+)+c(H+),因c(Na+)=0.1mol/L,则c(CN-)+c(OH-)>0.1mol/L,故D错误;
故选B.
B.溶液中c(CN-)小于c(Na+),则说明混合溶液中以CN-的水解程度大于HCN的电离程度,所以c(HCN)>c(CN-),故B正确;
C.HCN和NaCN的物质的量都为0.1mol,由物料守恒可知c(CN-)+c(HCN)=0.2mol/L,故C错误;
D.溶液中存在c(CN-)+c(OH-)=c(Na+)+c(H+),因c(Na+)=0.1mol/L,则c(CN-)+c(OH-)>0.1mol/L,故D错误;
故选B.
点评:本题考查离子浓度大小比较,题目难度中等,注意把握离子浓度大小的方法,解题时注意守恒思想的应用.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
“群众利益无小事,食品安全是大事”.下列做法不会损害人体健康的是( )
| A、用干冰保藏易变质的食品 |
| B、用硫磺熏制白木耳、粉丝等食品 |
| C、用甲醛浸泡易腐烂的食品 |
| D、用含亚硝酸钠的工业用盐腌制食品 |
有水存在时LiCl受热水解,且LiOH易分解,现将LiCl水溶液蒸干并灼烧后,再熔化进行电解.下列有关电极产物的判断正确的是( )
| A、阳极产生H2 |
| B、阳极产生O2 |
| C、阴产生Li和H2 |
| D、阴极只产生H2 |
已知:4NH3+5O2═4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列关系正确的是( )
| A、4v(NH3)=5v(O2) |
| B、5v(O2)=6v(H2O) |
| C、3v(NH3)=2v(H2O) |
| D、5v(O2)=4v(NO) |
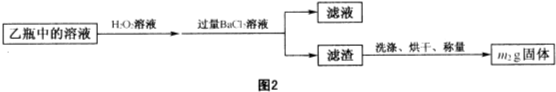
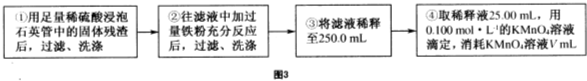
 黄铁矿(主要成分为FeS2,含少量其他金属硫化物)曾是我国一些硫酸厂制取硫酸够主要原料.某化学学习小组对黄铁矿石进行如下实验探究:
黄铁矿(主要成分为FeS2,含少量其他金属硫化物)曾是我国一些硫酸厂制取硫酸够主要原料.某化学学习小组对黄铁矿石进行如下实验探究: