题目内容
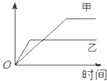 表格中的各种情况,可以用如图的曲线表示的是( )
表格中的各种情况,可以用如图的曲线表示的是( )| 反 应 | 纵坐标 | 甲 | 乙 | |
| A | 相同质量的氨,在同一容器中2NH3═N2+3H2△H<0 | 氨气的转化率 | 500℃ | 400℃ |
| B | 等质量钾、钠分别与足量水反应 | H2质量 | 钠 | 钾 |
| C | 在体积可变的恒压容器中,体积比1:3的N2、H2, N2+3H2═2NH3 | 氨气的浓度 | 活性高的催化剂 | 活性一般的催化剂 |
| D | 2molSO2和1molO2,在相同温度下 2SO2+O2═2SO3 | SO3物质的量 | 2个大气压 | 10个大气压 |
| A、A | B、B | C、C | D、D |
考点:化学反应速率与化学平衡图象的综合应用
专题:
分析:A、温度越高化学发应速率越快;
B、根据金属钾和金属钠与水的反应进行回答;
C、催化剂只能加快反应速率,不引起平衡移动;
D、增大压强化学平衡向着气体体积减小的方向进行.
B、根据金属钾和金属钠与水的反应进行回答;
C、催化剂只能加快反应速率,不引起平衡移动;
D、增大压强化学平衡向着气体体积减小的方向进行.
解答:
解:A、对于反应2NH3?N2+3H2,温度越高化学发应速率越快,所以甲达到化学平衡用的时间短,故A错误;
B、根据金属钾和金属钠与水反应的原理方程式可知,2Na~H2,2K~H2,等质量钾、钠,则金属钠的物质的量大,所以金属钠产生的氢气多,金属钾的活泼性强与金属钠,所以金属钾的反应速率快,故B正确;
C、催化剂只能加快反应速率,不引起平衡移动,所以甲和乙达到化学平衡时,氨气的浓度相等,故C错误;
D、对于反应2SO2+O2?2SO3,增大压强化学平衡向着正反应方向进行,所以达到平衡时,乙的三氧化硫的量高于甲的,故D错误.
故选B.
B、根据金属钾和金属钠与水反应的原理方程式可知,2Na~H2,2K~H2,等质量钾、钠,则金属钠的物质的量大,所以金属钠产生的氢气多,金属钾的活泼性强与金属钠,所以金属钾的反应速率快,故B正确;
C、催化剂只能加快反应速率,不引起平衡移动,所以甲和乙达到化学平衡时,氨气的浓度相等,故C错误;
D、对于反应2SO2+O2?2SO3,增大压强化学平衡向着正反应方向进行,所以达到平衡时,乙的三氧化硫的量高于甲的,故D错误.
故选B.
点评:本题是一道图象题,注意拐点处的含义以及化学反应速率和化学平衡的影响因素知识,可以根据教材知识来回答,难度中等.

练习册系列答案
相关题目
已知:4NH3+5O2═4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列关系正确的是( )
| A、4v(NH3)=5v(O2) |
| B、5v(O2)=6v(H2O) |
| C、3v(NH3)=2v(H2O) |
| D、5v(O2)=4v(NO) |
下列各组有机化合物中,肯定互为同系物的一组是( )
| A、C3H6与C5H10 |
| B、C4H6与C5H8 |
| C、C3H8与C5H12 |
| D、C2H2与C6H6 |
下列说法正确的是( )
| A、Na2O、Na2O2组成元素相同,但与CO2反应的产物不同 |
| B、2Na2O2+2H2O═4NaOH+O2↑ Na2O2是氧化剂H2O是还原剂 |
| C、Na2O2溶于水产生O2的离子方程式为:Na2O2+H2O═2Na++2OH-十O2↑ |
| D、Na2O2用作呼吸面具的供氧剂时氧元素即被氧化又被还原 |
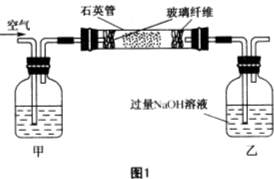 黄铁矿(主要成分为FeS2,含少量其他金属硫化物)曾是我国一些硫酸厂制取硫酸够主要原料.某化学学习小组对黄铁矿石进行如下实验探究:
黄铁矿(主要成分为FeS2,含少量其他金属硫化物)曾是我国一些硫酸厂制取硫酸够主要原料.某化学学习小组对黄铁矿石进行如下实验探究: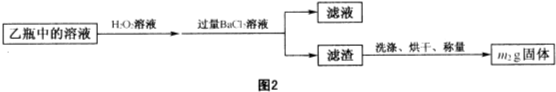
 有的油田开采的石油中溶有一种碳氢化合物--金刚烷,它的分子立体结构如图所示:
有的油田开采的石油中溶有一种碳氢化合物--金刚烷,它的分子立体结构如图所示: