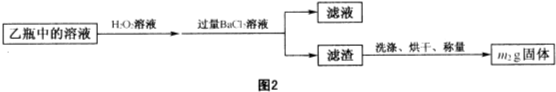
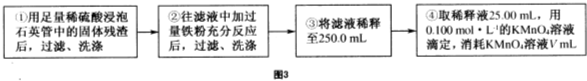
题目内容
同条件等体积等pH的醋酸和盐酸分别加水稀释后,溶液的pH仍相同,则所得溶液的体积( )
| A、仍相同 | B、醋酸大 |
| C、盐酸大 | D、无法判断 |
考点:弱电解质在水溶液中的电离平衡
专题:
分析:根据醋酸是弱电解质,加水稀释有利于电离平衡正向移动,而盐酸是强电解质,不存在电离平衡.
解答:
解:因为醋酸是弱酸,加水后反应正向进行,醋酸电离度增加,加水后,氢离子浓度在减小的过程中有增大的趋势,而盐酸是强酸在水中完全电离,加水后,氢离子浓度只是在减小,所以要使稀释后两溶液pH值相同,醋酸必须加水多,所以醋酸的体积大,故选B.
点评:本题考查了稀释对强弱电解质的不同影响,加水稀释,弱电解质的电离平衡会向右移动,这样生成的离子浓度在减小的同时还有增大的趋势.

练习册系列答案
相关题目
下列实验可以达到预期实验目的是( )
| A、实验内容:将木炭与浓硫酸共热,得到的气体通入澄清石灰水.实验目的:检验木炭的氧化产物是CO2. |
| B、实验内容:加入足量铁屑,充分反应后,过滤.实验目的:除去FeCl2溶液中的少量FeCl3. |
| C、实验内容:将1moLCuSO4?5H2O溶解在1L 水中.实验目的:制备1moL/L的CuSO4溶液 |
| D、实验内容:饱和氯化铁溶液中滴加氨水.实验目的:制备Fe(OH)3胶体 |
下列有关制取蒸馏水的装置和操作的说法中,不正确的是( )
| A、温度计的水银球应插入蒸馏烧瓶内的自来水中 |
| B、冷凝管内水的流向是下进上出 |
| C、实验中需在自来水中加几片碎瓷片 |
| D、蒸馏烧瓶底部必须垫石棉网 |
在2A+B?3C+4D反应中,表示该反应速率最快的是( )
| A、v(B)=0.3 mol?L-1?s-1 |
| B、v(A)=0.5 mol?L-1?s-1 |
| C、v(C)=0.6 mol?L-1?s-1 |
| D、v(D)=1 mol?L-1?s-1 |
已知:4NH3+5O2═4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列关系正确的是( )
| A、4v(NH3)=5v(O2) |
| B、5v(O2)=6v(H2O) |
| C、3v(NH3)=2v(H2O) |
| D、5v(O2)=4v(NO) |
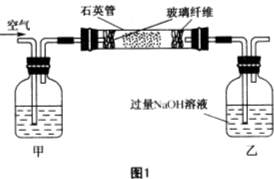 黄铁矿(主要成分为FeS2,含少量其他金属硫化物)曾是我国一些硫酸厂制取硫酸够主要原料.某化学学习小组对黄铁矿石进行如下实验探究:
黄铁矿(主要成分为FeS2,含少量其他金属硫化物)曾是我国一些硫酸厂制取硫酸够主要原料.某化学学习小组对黄铁矿石进行如下实验探究: