题目内容
随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具体有重要意义.
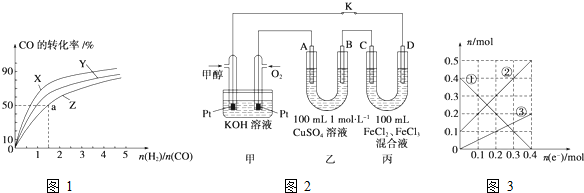
(1)如图1是在101kPa,298K条件下1mol NO2和1mol CO反应生成1mol CO2和1mol NO过程中的能量变化示意图.
已知:①N2(g)+O2(g)═2NO(g)△H=+179.5kJ/mol
②2NO(g)+O2(g)═2NO2(g)△H=-112.3kJ/mol
请写出NO与CO反应生成无污染气体的热化学方程式: .
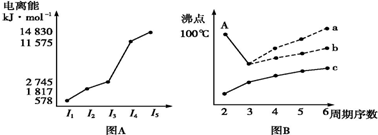
(2)将0.20mol N02和0.10mol CO充入一个容积恒定为1L的密闭容器中发生反应,在不同条件下,反应过程中部分物质的浓度变化状况如图2所示.
①下列说法正确的是 (填序号).
a.容器内的压强不发生变化说明该反应达到乎衡
b.当向容器中再充人0.20mol NO时,平衡向正反应方向移动,K增大
c.升高温度后,K减小,N02的转化率减小
d.向该容器内充人He气,反应物的体积减小,浓度增大,所以反应速率增大
②计算产物NO在0~2min内平均反应速率钞(NO)= mol?L-1?min-1
③第4min时改变的反应条件为 (填“升温”、“降温”).
④计算反应在第6min时的平衡常数K= .若保持温度不变,此时再向容器中充人CO、NO各0.060mol,平衡将 移动(填“正向”、“逆向”或“不”).
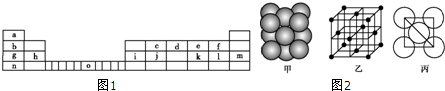
(3)Al-AgO池是一种新型电源,其原理如图3所示:该电池负极反应式为:
(4)以熔融盐为电镀液可以在钢材表面镀铝,镀铝电解池中金属铝为 极;镀铝后能防止钢材腐蚀,其原因是 .

(1)如图1是在101kPa,298K条件下1mol NO2和1mol CO反应生成1mol CO2和1mol NO过程中的能量变化示意图.
已知:①N2(g)+O2(g)═2NO(g)△H=+179.5kJ/mol
②2NO(g)+O2(g)═2NO2(g)△H=-112.3kJ/mol
请写出NO与CO反应生成无污染气体的热化学方程式:
(2)将0.20mol N02和0.10mol CO充入一个容积恒定为1L的密闭容器中发生反应,在不同条件下,反应过程中部分物质的浓度变化状况如图2所示.
①下列说法正确的是
a.容器内的压强不发生变化说明该反应达到乎衡
b.当向容器中再充人0.20mol NO时,平衡向正反应方向移动,K增大
c.升高温度后,K减小,N02的转化率减小
d.向该容器内充人He气,反应物的体积减小,浓度增大,所以反应速率增大
②计算产物NO在0~2min内平均反应速率钞(NO)=
③第4min时改变的反应条件为
④计算反应在第6min时的平衡常数K=
(3)Al-AgO池是一种新型电源,其原理如图3所示:该电池负极反应式为:
(4)以熔融盐为电镀液可以在钢材表面镀铝,镀铝电解池中金属铝为
考点:物质的量或浓度随时间的变化曲线,热化学方程式,常见化学电源的种类及其工作原理,化学平衡的影响因素,化学平衡状态的判断
专题:基本概念与基本理论
分析:(1)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(2)①依据化学平衡移动原理,反应的特征分析判断选项中平衡影响因素和反应速率影响因素;
②依据图象数据分析计算;
③图象分析判断4min后反应物浓度增大,生成物浓度减小,说明平衡逆向进行,反应是放热反应,升温改变符合图象变化;
④依据图象读出平衡浓度,结合平衡常数概念计算平衡常数,再加入物质浓度,可以利用浓度商计算和平衡常数比较判断反应进行的方向;
(3)Al为负极,在碱性条件下放电生成AlO2-、H2O;
(4)电镀池中镀层金属作阳极,镀层金属作阳极;在空气中铝表面能形成一层致密的氧化膜,从而保护钢材不被腐蚀.
(2)①依据化学平衡移动原理,反应的特征分析判断选项中平衡影响因素和反应速率影响因素;
②依据图象数据分析计算;
③图象分析判断4min后反应物浓度增大,生成物浓度减小,说明平衡逆向进行,反应是放热反应,升温改变符合图象变化;
④依据图象读出平衡浓度,结合平衡常数概念计算平衡常数,再加入物质浓度,可以利用浓度商计算和平衡常数比较判断反应进行的方向;
(3)Al为负极,在碱性条件下放电生成AlO2-、H2O;
(4)电镀池中镀层金属作阳极,镀层金属作阳极;在空气中铝表面能形成一层致密的氧化膜,从而保护钢材不被腐蚀.
解答:
解:(1)①N2(g)+O2(g)=2NO(g)△H=+179.5kJ/mol
②2NO(g)+O2(g)=2NO2(g)△H=-112.3kJ/mol
298k条件下1mol NO2和1mol CO反应生成1mol CO2和1mol NO的热化学方程式为③2NO2(g)+4CO(g)=N2(g)+4CO2(g)△H=-(368-134)KJ/mol=-232KJ/mol,
由盖斯定律(②-①+③)÷2得到反应的热化学方程式:2NO(g)+2CO(g)?N2(g)+2CO2(g)的△H=-759KJ/mol,
故答案为:2NO(g)+2CO(g)?N2(g)+2CO2(g)的△H=-759KJ/mol;
(2)图象分析可知反应为:NO2(g)+CO(g)?NO(g)+CO2(g),
①a.反应前后气体体积不变,当容器内的压强不发生变化,不能说明该反应达到平衡,故a错误;
b.当向容器中加再充入0.20mol NO时,平衡向逆反应方向移动,K值不变,故b错误;
c.升高温度后,K值减小,说明平衡逆向进行,NO2的转化率减小,故c正确;
d.向该容器内充入He气,总压增大,气体分压不变,所以反应反应速率不变,故d错误;
故选c;
②产物NO2在0~2min时平均反应速率v(NO2)=
=0.015mol/L?min,故答案为:0.015;
③图象分析可知4min后二氧化氮和一氧化碳浓度增大,一氧化氮和二氧化碳浓度减小,说明平衡逆向进行,反应是放热反应,升温平衡逆向进行,符合图象变化,
故答案为:升温;
④依据图象分析,6min时平衡状态下物质的浓度为c(NO2)=0.18mol/L,c(CO)=0.08mol/L,c(NO)=0.02mol/L,c(CO2)=0.02mol/L,反应的平衡常数依据平衡常数概念计算,NO2(g)+CO(g)?NO(g)+CO2(g),K=
=
;若保持温度不变,此时再向容器中充入CO、NO各0.060mol,浓度商计算Qc=
=
>K,平衡逆向进行,
故答案为:
;逆向;
(3)Al为负极,在碱性条件下放电生成AlO2-、H2O,负极电极反应式为:Al+4OH--3e-=AlO2-+2H2O,
故答案为:Al+4OH--3e-=AlO2-+2H2O;
(4)电镀池中镀层金属作阳极,镀层金属作阳极,故在钢材表面镀铝,镀铝电解池中,金属铝为阳极,在空气中铝表面能形成一层致密的氧化膜,从而保护钢材不被腐蚀,
故答案为:阳;在空气中铝表面能形成一层致密的氧化膜,从而保护钢材不被腐蚀.
②2NO(g)+O2(g)=2NO2(g)△H=-112.3kJ/mol
298k条件下1mol NO2和1mol CO反应生成1mol CO2和1mol NO的热化学方程式为③2NO2(g)+4CO(g)=N2(g)+4CO2(g)△H=-(368-134)KJ/mol=-232KJ/mol,
由盖斯定律(②-①+③)÷2得到反应的热化学方程式:2NO(g)+2CO(g)?N2(g)+2CO2(g)的△H=-759KJ/mol,
故答案为:2NO(g)+2CO(g)?N2(g)+2CO2(g)的△H=-759KJ/mol;
(2)图象分析可知反应为:NO2(g)+CO(g)?NO(g)+CO2(g),
①a.反应前后气体体积不变,当容器内的压强不发生变化,不能说明该反应达到平衡,故a错误;
b.当向容器中加再充入0.20mol NO时,平衡向逆反应方向移动,K值不变,故b错误;
c.升高温度后,K值减小,说明平衡逆向进行,NO2的转化率减小,故c正确;
d.向该容器内充入He气,总压增大,气体分压不变,所以反应反应速率不变,故d错误;
故选c;
②产物NO2在0~2min时平均反应速率v(NO2)=
| (0.2-0.17)mol/L |
| 2min |
③图象分析可知4min后二氧化氮和一氧化碳浓度增大,一氧化氮和二氧化碳浓度减小,说明平衡逆向进行,反应是放热反应,升温平衡逆向进行,符合图象变化,
故答案为:升温;
④依据图象分析,6min时平衡状态下物质的浓度为c(NO2)=0.18mol/L,c(CO)=0.08mol/L,c(NO)=0.02mol/L,c(CO2)=0.02mol/L,反应的平衡常数依据平衡常数概念计算,NO2(g)+CO(g)?NO(g)+CO2(g),K=
| 0.2×0.2 |
| 0.18×0.8 |
| 1 |
| 36 |
| 0.08×0.02 |
| 0.18×0.10 |
| 4 |
| 45 |
故答案为:
| 1 |
| 36 |
(3)Al为负极,在碱性条件下放电生成AlO2-、H2O,负极电极反应式为:Al+4OH--3e-=AlO2-+2H2O,
故答案为:Al+4OH--3e-=AlO2-+2H2O;
(4)电镀池中镀层金属作阳极,镀层金属作阳极,故在钢材表面镀铝,镀铝电解池中,金属铝为阳极,在空气中铝表面能形成一层致密的氧化膜,从而保护钢材不被腐蚀,
故答案为:阳;在空气中铝表面能形成一层致密的氧化膜,从而保护钢材不被腐蚀.
点评:本题考查了热化学方程式和盖斯定律计算应用,化学平衡影响因素分析,平衡常数计算应用,原电池原理的理解分析,溶度积常数的计算分析,掌握基础是关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列表示对应化学反应的离子方程式正确的是( )
| A、用NaClO除去水体中CO(NH2)2产生CO2和N2,3ClO-+CO(NH2)2═3Cl-+CO2↑+N2↑+2H2O |
| B、过氧化氢能使酸性KMnO4溶液褪色:3H2O2+2MnO4-+6H+═2Mn2++4O2↑+6H2O |
| C、用小苏打治疗胃酸过多:CO32-+2H+═CO2↑+H2O |
| D、向Ba(OH)2溶液中逐滴加入溶液恰好沉淀完全:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
与Li<Na<K<Rb<Cs的变化规律不符合的是( )
| A、与水或酸反应置换氢气越来越剧烈 |
| B、对应元素的金属性由弱到强 |
| C、对应金属阳离子氧化性由弱到强 |
| D、原子半径由小到大 |
下列说法正确的是( )
| A、将等体积、等pH的氢氧化钠溶液和氨水分别稀释相同倍数,氨水的pH变化大 |
| B、金属钾、钠和白磷等暴露在空气中易燃烧,所以金属钾、钠和白磷应保存在煤油中 |
| C、向滴有酚酞的Na2CO3溶液中逐滴加入Ba(NO3)2,红色逐渐褪去,说明Na2CO3溶液中存在水解平衡 |
| D、在制备硝酸钾晶体的实验中,趁热过滤时,承接滤液的小烧杯中先加2mL的水,以防过滤时硝酸钾晶体过早析出 |
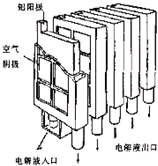 近年来,金属-空气电池的研究和应用取得很大进步这种新型燃料电池具有比能量高、对环境友好、应用场合多等多方面优点.铝-空气电池工作原理如图所示.关于金属-空气电池的说法不正确的是( )
近年来,金属-空气电池的研究和应用取得很大进步这种新型燃料电池具有比能量高、对环境友好、应用场合多等多方面优点.铝-空气电池工作原理如图所示.关于金属-空气电池的说法不正确的是( )| A、铝-空气电池(如图)中,铝作负极,电子通过外电路到正极 |
| B、为帮助电子与空气中的氧气反应,可使用活性炭作正极材料 |
| C、碱性溶液中,负极反应为Al(s)+3OH-(aq)═Al(OH)3(s)+3e-,每消耗2.7g Al(s),需耗氧6.72L(标准状况) |
| D、金属-空气电池的可持续应用要求是一方面在工作状态下要有足够的氧气供应,另一方面在非工作状态下能够密封防止金属自腐蚀 |
下列说法错误的是( )
| A、向蛋白质溶液中加入CuSO4溶液发生蛋白质变性 |
| B、煤焦油中含有苯、二甲苯等化工原料 |
| C、天然气和可燃冰的主要成分都是甲烷 |
| D、石油裂解的主要目的是为了得到更多的汽油 |
 .
.