题目内容
甲、乙、丙三种物质在一定条件下存在如下转化关系(反应中部分产物已略去):
 .
.
回答下列问题:
(1)若乙为乙醇,金属A的组成元素是短周期主族元素中原子半径最大的元素,反应①的化学方程式为 .丙的结构简式可能是 .
(2)若乙为单质,其原子中最外层电子数是其电子层数的2倍,A为钾,B与A同主族,用pH试纸测定甲溶液和丙溶液的酸碱性,试纸分别呈蓝色和红色.
①写出A的组成元素在周期表中的位置 .
②丙溶液使pH试纸变红色的原因是(用离子方程式表示) .
③甲溶液中各种阴离子浓度由大到小的顺序为 .
(3)若甲是磁性氧化铁,乙是水,B为碳,丙是水煤气.
①已知相同条件下当1摩气态水参加反应时,反应①的焓变△H=+a kJ?mol-1,反应②的焓变△H=+b kJ?mol-1,则相同条件下Fe3O4固体与固态碳反应生成固态Fe和气态CO的热化学方程式为 .
②密闭容器中反应Fe3O4(s)+4CO(g)═3Fe(s)+4CO2(g)为可逆反应,该反应的平衡常数表达式为 ,某温度下该反应K=8.1×10-3,该温度下在密闭容器中加入1.0mol Fe3O4 和5.2mol CO,平衡时CO的转化率为 .
③一定条件下,氧化铁可以转化为磁性氧化铁,反应中,氧化铁发生 反应(填“氧化”或“还原”).
 .
.回答下列问题:
(1)若乙为乙醇,金属A的组成元素是短周期主族元素中原子半径最大的元素,反应①的化学方程式为
(2)若乙为单质,其原子中最外层电子数是其电子层数的2倍,A为钾,B与A同主族,用pH试纸测定甲溶液和丙溶液的酸碱性,试纸分别呈蓝色和红色.
①写出A的组成元素在周期表中的位置
②丙溶液使pH试纸变红色的原因是(用离子方程式表示)
③甲溶液中各种阴离子浓度由大到小的顺序为
(3)若甲是磁性氧化铁,乙是水,B为碳,丙是水煤气.
①已知相同条件下当1摩气态水参加反应时,反应①的焓变△H=+a kJ?mol-1,反应②的焓变△H=+b kJ?mol-1,则相同条件下Fe3O4固体与固态碳反应生成固态Fe和气态CO的热化学方程式为
②密闭容器中反应Fe3O4(s)+4CO(g)═3Fe(s)+4CO2(g)为可逆反应,该反应的平衡常数表达式为
③一定条件下,氧化铁可以转化为磁性氧化铁,反应中,氧化铁发生
考点:无机物的推断
专题:推断题
分析:(1)若乙为乙醇,金属A的组成元素是短周期主族元素中原子半径最大的元素为Na,乙醇在非金属单质B中反应可能是燃烧生成二氧化碳或一氧化碳,催化氧化生成乙醛,最后生成乙酸;
(2)若乙为单质,其原子中最外层电子数是其电子层数的2倍,判断乙为C或S,A为钾,乙和甲反应生成甲为K2S,所以推断乙为S,B与A同主族,用pH试纸测定甲溶液和丙溶液的酸碱性,试纸分别呈蓝色说明是呈碱性,硫离子水解显碱性,乙和非金属单质B反应生成的丙溶液呈红色说明是酸性溶液,推断为H2S,B为H2;
①题干信息可知,A为K,A的组成元素在周期表中的位置第四周期第ⅠA族;
②丙为H2S,溶液使pH试纸变红色的原因是硫化氢水溶液中存在电离平衡电离出氢离子
③甲溶液为Na2S的溶液,溶液中硫离子分步水解显碱性-;
(3)若甲是磁性氧化铁,乙是水,则金属A为Fe,B为碳,丙是水煤气为H2、CO;
①依据题干书写热化学方程式,结合盖斯定律计算得到所需热化学方程式;
②平衡常数是利用生成物平衡浓度幂次方乘积,除以反应物幂次方乘积得到;依据平衡三段式列式计算转化率=
×100%;
③元素化合价从+3价变化为+2价,元素化合价降低,做氧化剂被还原发生还原反应.
(2)若乙为单质,其原子中最外层电子数是其电子层数的2倍,判断乙为C或S,A为钾,乙和甲反应生成甲为K2S,所以推断乙为S,B与A同主族,用pH试纸测定甲溶液和丙溶液的酸碱性,试纸分别呈蓝色说明是呈碱性,硫离子水解显碱性,乙和非金属单质B反应生成的丙溶液呈红色说明是酸性溶液,推断为H2S,B为H2;
①题干信息可知,A为K,A的组成元素在周期表中的位置第四周期第ⅠA族;
②丙为H2S,溶液使pH试纸变红色的原因是硫化氢水溶液中存在电离平衡电离出氢离子
③甲溶液为Na2S的溶液,溶液中硫离子分步水解显碱性-;
(3)若甲是磁性氧化铁,乙是水,则金属A为Fe,B为碳,丙是水煤气为H2、CO;
①依据题干书写热化学方程式,结合盖斯定律计算得到所需热化学方程式;
②平衡常数是利用生成物平衡浓度幂次方乘积,除以反应物幂次方乘积得到;依据平衡三段式列式计算转化率=
| 消耗量 |
| 起始量 |
③元素化合价从+3价变化为+2价,元素化合价降低,做氧化剂被还原发生还原反应.
解答:
解:(1)若乙为乙醇,金属A的组成元素是短周期主族元素中原子半径最大的元素为Na,反应的化学方程式为:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑;乙醇在非金属单质B中反应可能是燃烧生成二氧化碳或一氧化碳,催化氧化生成乙醛,最后生成乙酸;
故答案为:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑;CO或CO2或CH3CHO或CH3COOH;
(2)若乙为单质,其原子中最外层电子数是其电子层数的2倍,判断乙为C或S,A为钾,乙和甲反应生成甲为K2S,所以推断乙为S,B与A同主族,用pH试纸测定甲溶液和丙溶液的酸碱性,试纸分别呈蓝色说明是呈碱性,硫离子水解显碱性,乙和非金属单质B反应生成的丙溶液呈红色说明是酸性溶液,推断为H2S,B为H2;
①题干信息可知,A为K,A的组成元素在周期表中的位置第四周期第ⅠA族;
故答案为:第四周期第ⅠA族;
②丙为H2S,溶液使pH试纸变红色的原因是硫化氢水溶液中存在电离平衡电离出氢离子,H2S?H++HS-;
故答案为:H2S?H++HS-;
③甲溶液为Na2S的溶液,溶液中各种阴离子浓度由大到小的顺序为:S2->OH->HS-;
故答案为:S2->OH->HS-;
(3)①已知相同条件下当1摩气态水参加反应时,反应①的焓变△H=+a kJ?mol-1,反应的热化学方程式为:3Fe(s)+4H2O(g)=Fe3O4(s)+4H2,△H=+aKJ/mol;反应②的焓变△H=+b kJ?mol-1,热化学方程式为:C(s)+H2O(g)=CO(g)+H2(g)△H═+b kJ?mol-1;则依据盖斯定律计算,②×4-①得到相同条件下Fe3O4固体与固态碳反应生成固态Fe和气态CO的热化学方程式为:Fe3O4(s)+4C(s)=3Fe(s)+4CO(g)△H=(4b-a)KJ/mol;
故答案为:Fe3O4(s)+4C(s)=3Fe(s)+4CO(g)△H=(4b-a)KJ/mol;
②密闭容器中反应Fe3O4(s)+4CO(g)═3Fe(s)+4CO2(g)为可逆反应,反应的平衡常数K=
;某温度下该反应K=8.1×10-3,该温度下在密闭容器中加入1.0mol Fe3O4 和5.2mol CO,依据平衡三段式列式得到,设消耗一氧化碳物质的量为x;
Fe3O4(s)+4CO(g)═3Fe(s)+4CO2(g)
起始量(mol) 1.0 5.2mol 0 0
变化量(mol) x x
平衡量(mol) 5.2-x x
=8.1×10-3;
x=1.2mol
平衡时CO的转化率=
×100%=23.1%;
故答案为:23.1%;
③氧化铁可以转化为磁性氧化铁,铁元素化合价降低,说明做氧化剂被 还原发生还原反应;
故答案为:还原.
故答案为:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑;CO或CO2或CH3CHO或CH3COOH;
(2)若乙为单质,其原子中最外层电子数是其电子层数的2倍,判断乙为C或S,A为钾,乙和甲反应生成甲为K2S,所以推断乙为S,B与A同主族,用pH试纸测定甲溶液和丙溶液的酸碱性,试纸分别呈蓝色说明是呈碱性,硫离子水解显碱性,乙和非金属单质B反应生成的丙溶液呈红色说明是酸性溶液,推断为H2S,B为H2;
①题干信息可知,A为K,A的组成元素在周期表中的位置第四周期第ⅠA族;
故答案为:第四周期第ⅠA族;
②丙为H2S,溶液使pH试纸变红色的原因是硫化氢水溶液中存在电离平衡电离出氢离子,H2S?H++HS-;
故答案为:H2S?H++HS-;
③甲溶液为Na2S的溶液,溶液中各种阴离子浓度由大到小的顺序为:S2->OH->HS-;
故答案为:S2->OH->HS-;
(3)①已知相同条件下当1摩气态水参加反应时,反应①的焓变△H=+a kJ?mol-1,反应的热化学方程式为:3Fe(s)+4H2O(g)=Fe3O4(s)+4H2,△H=+aKJ/mol;反应②的焓变△H=+b kJ?mol-1,热化学方程式为:C(s)+H2O(g)=CO(g)+H2(g)△H═+b kJ?mol-1;则依据盖斯定律计算,②×4-①得到相同条件下Fe3O4固体与固态碳反应生成固态Fe和气态CO的热化学方程式为:Fe3O4(s)+4C(s)=3Fe(s)+4CO(g)△H=(4b-a)KJ/mol;
故答案为:Fe3O4(s)+4C(s)=3Fe(s)+4CO(g)△H=(4b-a)KJ/mol;
②密闭容器中反应Fe3O4(s)+4CO(g)═3Fe(s)+4CO2(g)为可逆反应,反应的平衡常数K=
| c4(CO2) |
| c4(CO) |
Fe3O4(s)+4CO(g)═3Fe(s)+4CO2(g)
起始量(mol) 1.0 5.2mol 0 0
变化量(mol) x x
平衡量(mol) 5.2-x x
| x4 |
| (5.2-x)4 |
x=1.2mol
平衡时CO的转化率=
| 1.2mol |
| 5.2mol |
故答案为:23.1%;
③氧化铁可以转化为磁性氧化铁,铁元素化合价降低,说明做氧化剂被 还原发生还原反应;
故答案为:还原.
点评:本题考查了物质转化关系和物质性质的分析判断,掌握物质性质和推断反应现象、特征反应和现象是解题关键,题目难度中等.

练习册系列答案
相关题目
据和讯网2012年10月24日报道,中国目前正面临严重的能源危机,发展利用可再生能源是解决中国能源危机的有效途径.下列有关说法正确的是( )
| A、氢气是二次能源 |
| B、煤、石油、天然气均为化石能源 |
| C、只有农业废弃物、水生植物、油料植物中蕴含着丰富的生物质能 |
| D、太阳能是不可再生资源 |
食盐主要成分是NaCl,还含有SO42-等其他可溶性杂质离子.下列说法不正确的是( )
| A、除去SO42-最合适的试剂是BaCl2 |
| B、工业上通过电解氯化钠溶液制备金属钠和氯气 |
| C、室温下,AgCl在水中的溶解度大于在食盐水中的溶解度 |
| D、用酚酞试液可鉴别饱和食盐水和饱和纯碱溶液 |
下列物质中,不能发生消去反应的是( )
A、 |
| B、CH2BrCH2Br |
C、 |
| D、CH2═CHBr |
己知:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-25kJ?mol-1.某温度下的平衡常数为400.此温度下,在1L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如表,下列说法中不正确的是( )
| 物质 | CH3OH | CH3OCH3 | H2O |
| c/(mol?L-1) | 0.08 | 1.6 | 1.6 |
| A、此时刻反应达到平衡状态 |
| B、容器内压强不变时,说明反应达平衡状态 |
| C、平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率不变 |
| D、平衡时,反应混合物的总能量降低40kJ |
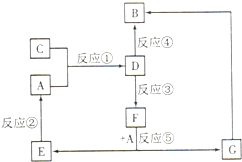 A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含有同种元素.已知:
A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含有同种元素.已知: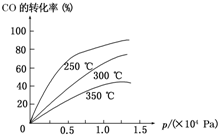 工业上一般在密闭容器中采用下列反应合成甲醇:
工业上一般在密闭容器中采用下列反应合成甲醇: