题目内容
7.有A、B、C、D、E、F六种元素,试按下述所给条件推断:①A、B、C是同一周期的金属元素,已知原子核外有3个电子层,原子半径A>B>C ②D、E、F是同主族非金属元素,它们与氢化合可生成气态氢化物HD、HE、HF,在室温时,E的单质是液体是液体,F的单质是固体;D是除氢外原子半径最小的元素.(1)B、C的简单离子的氧化性强弱(用离子符号表示)Mg2+<Al3+,
(2)气态氢化物HD、HE、HF的稳定性由强到弱是(用分子式表示)HF>HBr>HI,D、E、F离子的还原性由强到弱是(用离子符号表示)I->Br->F-;.
(3)在上述六种元素中,最高价氧化物对应的水化物碱性最强的是_NaOH(填物质化学式)
(4)请写出A与E的最高价氧化物对应水化物相互反应的离子方程式H++OH-=H2O.
分析 有A、B、C、D、E、F六种主族元素,①A、B、C是同一周期的金属元素,原子核外有3个电子层,原子半径A>B>C,则A为Na、B为Mg、C为Al;②D、E、F是同主族非金属元素,它们与氢气化合可生成气态氢化物HD、HE、HF,均为ⅦA族元素,E的单质为液体,则E为Br;F的单质为固体,则F为I;D是除氢气外最轻的气体且性质稳定,则D为F元素,据此解答.
解答 解:有A、B、C、D、E、F六种主族元素,①A、B、C是同一周期的金属元素,原子核外有3个电子层,原子半径A>B>C,则A为Na、B为Mg、C为Al;②D、E、F是同主族非金属元素,它们与氢气化合可生成气态氢化物HD、HE、HF,均为ⅦA族元素,E的单质为液体,则E为Br;F的单质为固体,则F为I;D是除氢气外最轻的气体且性质稳定,则D为F元素.
(1)金属性Mg>Al,故简单离子的氧化性:Mg2+<Al3+,故答案为:Mg2+<Al3+;
(2)非金属性F>Br>I,故氢化物稳定性:HF>HBr>HI,非金属性越强,阴离子还原性越弱,故还原性:I->Br->F-,
故答案为:HF>HBr>HI;I->Br->F-;
(3)金属性最强的是钠,所以最高价氧化物对应的水化物碱性最强的是NaOH,故答案为:NaOH;
(4)A的最高价氧化物对应的水化物为NaOH,E的最高价氧化物对应的水化物为HBrO4,两者反应的离子方程式为:H++OH-=H2O,故答案为:H++OH-=H2O.
点评 本题考查位置结构与性质的关系,推断元素是解题关键,注意理解掌握金属性、非金属性强弱比较的实验事实,有利于基础知识的巩固.

练习册系列答案
相关题目
17.在两个密闭容器中,分别充满等物质的量的甲、乙两种气体,它们的温度和摩尔质量均相同.试根据甲、乙的密度(ρ)的关系,下列说法中正确的是( )
| A. | 若ρ(甲)<ρ(乙),则气体的压强:甲>乙 | B. | 若ρ(甲)>ρ(乙),则分子数:甲>乙 | ||
| C. | 若ρ(甲)<ρ(乙),则气体摩尔体积:甲<乙 | D. | 若ρ(甲)>ρ(乙),则气体体积:甲<乙 |
15.下列分子中所有原子都满足最外层8电子结构的是( )
| A. | 五氯化磷 | B. | 六氟化硫 | C. | 三氯化硼 | D. | 光气(COCl2) |
19.设NA为阿伏伽德罗常数的值.下列有关叙述错误的是( )
| A. | 80g CuO和Cu2S的混合物中,所含铜原子数为NA | |
| B. | 1mol NaBH4与足量水反应(NaBH4+H2O→NaBO2+H2↑,未配平)时转移的电子数为4NA | |
| C. | 常温下,2L 0.1 mol•L-1FeCl3 溶液与 1L 0.2 mol•L-1FeCl3 溶液所含 Fe3+数目不同 | |
| D. | 100g质量分数为46%的乙醇溶液中含有NA个-OH |
16. 最近科学家发现都由磷原子构成的黑磷(黑磷的磷原子二维结构如图)是比石墨烯更好的新型二维半导体材料.下列说法正确的是( )
最近科学家发现都由磷原子构成的黑磷(黑磷的磷原子二维结构如图)是比石墨烯更好的新型二维半导体材料.下列说法正确的是( )
 最近科学家发现都由磷原子构成的黑磷(黑磷的磷原子二维结构如图)是比石墨烯更好的新型二维半导体材料.下列说法正确的是( )
最近科学家发现都由磷原子构成的黑磷(黑磷的磷原子二维结构如图)是比石墨烯更好的新型二维半导体材料.下列说法正确的是( )| A. | 黑磷导电属于化学变化 | B. | 黑磷属于化合物 | ||
| C. | 黑磷与白磷互为同素异形体 | D. | 黑磷高温下在空气中可以稳定存在 |
17.已知A是碳元素,B是氧元素,C是钠元素,D是铝元素,下列说法正确的是( )
| A. | 原子半径:C>A | |
| B. | 气态氢化物的稳定性:A>B | |
| C. | 四种元素在同一周期 | |
| D. | 最高价氧化物对应水化物的碱性:C<D |
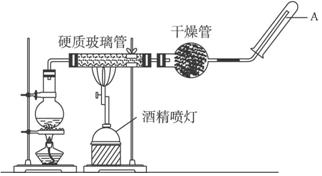 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应.
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应.