题目内容
17.在两个密闭容器中,分别充满等物质的量的甲、乙两种气体,它们的温度和摩尔质量均相同.试根据甲、乙的密度(ρ)的关系,下列说法中正确的是( )| A. | 若ρ(甲)<ρ(乙),则气体的压强:甲>乙 | B. | 若ρ(甲)>ρ(乙),则分子数:甲>乙 | ||
| C. | 若ρ(甲)<ρ(乙),则气体摩尔体积:甲<乙 | D. | 若ρ(甲)>ρ(乙),则气体体积:甲<乙 |
分析 两种气体的物质的量、摩尔质量相同,根据m=nM可知两种气体的质量相同,
A.若ρ(甲)<ρ(乙),根据V=$\frac{m}{ρ}$可知容器容积V:甲>乙,结合气体物质的量相等分析压强;
B.根据N=nNA知,分子数与物质的量成正比;
C.若ρ(甲)<ρ(乙),根据V=$\frac{m}{ρ}$可知容器容积V:甲>乙,根据Vm=$\frac{V}{n}$分析气体摩尔体积;
D.若ρ(甲)>ρ(乙),根据V=$\frac{m}{ρ}$可知分析容器容积V.
解答 解:两种气体的物质的量、摩尔质量相同,根据m=nM可知两种气体的质量相同,
A.若ρ(甲)<ρ(乙),根据V=$\frac{m}{ρ}$可知容器容积V:甲>乙,由于气体物质的量相等,容器体积越大压强越小,则气体的压强:甲<乙,故A错误;
B.根据N=nNA知,分子数与物质的量成正比,二者的物质的量相等,所以其分子数相等,故B错误;
C.若ρ(甲)<ρ(乙),则V=$\frac{m}{ρ}$可知容器容积V:甲>乙,根据Vm=$\frac{V}{n}$可知气体摩尔体积:甲>乙,故C错误;
D.若ρ(甲)>ρ(乙),则V=$\frac{m}{ρ}$可知分析容器容积V:甲<乙,故D正确;
故选D.
点评 本题考查了阿伏伽德罗定律及推论,题目难度中等,明确阿伏伽德罗定律内容及推理为解答关键,试题有利于提高学生的分析能力及逻辑推理能力.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
9.短周期元素R、T、X、Y、Z在元素周期表的相对位置如表所示,它们的最外层电子数之和为24.则下列判断正确的是( )
| R | T | |
| X | Y | Z |
| A. | R位于元素周期表中第二周期第VA族 | |
| B. | R能分别与X、Z形成共价化合物 | |
| C. | 原子半径大小顺序为X>T>Y | |
| D. | Z元素的最高价氧化物对应的水化的化学式为HZO4 |
5.(1)浓硫酸与木炭粉加热反应的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O
(2)试用图中所列各装置设计一个实验,验证上述反应所产生的各种产物.这种装置的连接顺序(按产物气流从左到右的方向)是(填图中装置的编号):④→②→①→③.
(3)实验时可观察到装置①中,A瓶的溶液褪色,C瓶的溶液不褪色.
A瓶溶液的作用是:检验产物气流中是否有SO2气体,
B瓶溶液的作用是将SO2全部氧化吸收,
C瓶溶液的作用是确证产物中SO2已被B瓶溶液全部氧化.
(4)装置②中所加的白色固体药品是无水硫酸铜,可验证的产物是水蒸气
(5)装置③中所盛的溶液是澄清石灰水,可验证的产物是CO2
(6)在各装置所盛的试剂不变的条件下,若装置的连接顺序为④→①→②→③,则可以检出的产物是SO2和CO2 (填化学式,下同),不能检出的产物是H2O.
(2)试用图中所列各装置设计一个实验,验证上述反应所产生的各种产物.这种装置的连接顺序(按产物气流从左到右的方向)是(填图中装置的编号):④→②→①→③.
| 编号 | ① | ② | ③ | ④ |
| 装置 |  |  |  |  |
A瓶溶液的作用是:检验产物气流中是否有SO2气体,
B瓶溶液的作用是将SO2全部氧化吸收,
C瓶溶液的作用是确证产物中SO2已被B瓶溶液全部氧化.
(4)装置②中所加的白色固体药品是无水硫酸铜,可验证的产物是水蒸气
(5)装置③中所盛的溶液是澄清石灰水,可验证的产物是CO2
(6)在各装置所盛的试剂不变的条件下,若装置的连接顺序为④→①→②→③,则可以检出的产物是SO2和CO2 (填化学式,下同),不能检出的产物是H2O.
12.把23g钠投入到m1 g足量的水中得到a g溶液,把24g镁投入到m2 g足量的盐酸中得到b g溶液,若m1=m2,则a,b的关系是( )
| A. | a>b | B. | a<b | C. | a=b | D. | 无法确定 |
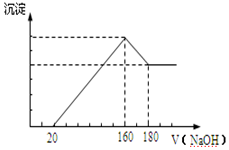 已知A、B、C、D、X、Y、Z七种短周期主族元素的原子序数依次增大,A是元素周期表中原子半径最小的,B的最高价氧化物的水化物与其氢化物反应生成盐,且B的核电荷数比Y的最外层电子数多1.C原子的最外层电子数是次外层电子数的3倍,D原子半径在同周期中除稀有气体外最大,X是同周期中简单离子半径最小的元素.请回答下列问题:
已知A、B、C、D、X、Y、Z七种短周期主族元素的原子序数依次增大,A是元素周期表中原子半径最小的,B的最高价氧化物的水化物与其氢化物反应生成盐,且B的核电荷数比Y的最外层电子数多1.C原子的最外层电子数是次外层电子数的3倍,D原子半径在同周期中除稀有气体外最大,X是同周期中简单离子半径最小的元素.请回答下列问题: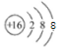 ,A与C形成的10电子分子的电子式为
,A与C形成的10电子分子的电子式为 .
. .
.