题目内容
15.下列分子中所有原子都满足最外层8电子结构的是( )| A. | 五氯化磷 | B. | 六氟化硫 | C. | 三氯化硼 | D. | 光气(COCl2) |
分析 分子中原子的最外层电子数可以根据每种元素原子的最外层电子数与化合价的绝对值之和来判断.
解答 解:A.PCl5中P元素化合价为+5,P原子最外层电子数为5,所以5+5=10,P原子不满足8电子结构;Cl元素化合价为-1,Cl原子最外层电子数为7,所以1+7=8,Cl原子满足8电子结构,故A错误;
B.六氯化硫中,S原子的原子核外最外层电子数为6,其在分子中的化合价为+6价,在分子中的原子最外层电子数为12,故B错误;
C.BF3中,B元素位于第ⅢA族,则3+3≠8,不满足分子中所有原子都满足最外层8电子结构,故C错误;
D.光气(COCl2)中,C原子的原子核外最外层电子数为4,其在分子中的化合价为+4价,所以满足最外层8电子结构;O原子的原子核外最外层电子数为6,其在分子中的化合价为-2价,所以满足最外层8电子结构;Cl原子的原子核外最外层电子数为7,其在分子中的化合价为-1价,所以满足最外层8电子结构,故D正确;
故选D.
点评 本题考查原子的结构,本题中注意判断是否满足8电子结构的方法,注意利用化合价与最外层电子数来分析即可解答,明确所有原子都满足最外层8电子结构是解答的关键,题目难度不大.

练习册系列答案
相关题目
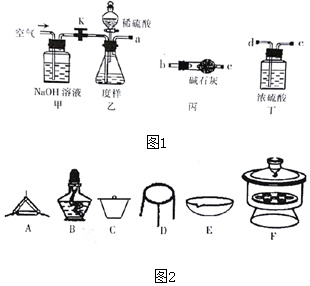
5.(1)浓硫酸与木炭粉加热反应的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O
(2)试用图中所列各装置设计一个实验,验证上述反应所产生的各种产物.这种装置的连接顺序(按产物气流从左到右的方向)是(填图中装置的编号):④→②→①→③.
(3)实验时可观察到装置①中,A瓶的溶液褪色,C瓶的溶液不褪色.
A瓶溶液的作用是:检验产物气流中是否有SO2气体,
B瓶溶液的作用是将SO2全部氧化吸收,
C瓶溶液的作用是确证产物中SO2已被B瓶溶液全部氧化.
(4)装置②中所加的白色固体药品是无水硫酸铜,可验证的产物是水蒸气
(5)装置③中所盛的溶液是澄清石灰水,可验证的产物是CO2
(6)在各装置所盛的试剂不变的条件下,若装置的连接顺序为④→①→②→③,则可以检出的产物是SO2和CO2 (填化学式,下同),不能检出的产物是H2O.
(2)试用图中所列各装置设计一个实验,验证上述反应所产生的各种产物.这种装置的连接顺序(按产物气流从左到右的方向)是(填图中装置的编号):④→②→①→③.
| 编号 | ① | ② | ③ | ④ |
| 装置 |  |  |  |  |
A瓶溶液的作用是:检验产物气流中是否有SO2气体,
B瓶溶液的作用是将SO2全部氧化吸收,
C瓶溶液的作用是确证产物中SO2已被B瓶溶液全部氧化.
(4)装置②中所加的白色固体药品是无水硫酸铜,可验证的产物是水蒸气
(5)装置③中所盛的溶液是澄清石灰水,可验证的产物是CO2
(6)在各装置所盛的试剂不变的条件下,若装置的连接顺序为④→①→②→③,则可以检出的产物是SO2和CO2 (填化学式,下同),不能检出的产物是H2O.
3.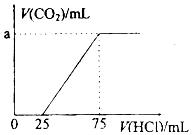 取一定量的NaOH溶液通入CO2后,再继续向该溶液中逐滴加入0.1mol/L的盐酸,产生CO2的体积与所加盐酸体积之间的关系如图所示,下列说法正确的是( )
取一定量的NaOH溶液通入CO2后,再继续向该溶液中逐滴加入0.1mol/L的盐酸,产生CO2的体积与所加盐酸体积之间的关系如图所示,下列说法正确的是( )
 取一定量的NaOH溶液通入CO2后,再继续向该溶液中逐滴加入0.1mol/L的盐酸,产生CO2的体积与所加盐酸体积之间的关系如图所示,下列说法正确的是( )
取一定量的NaOH溶液通入CO2后,再继续向该溶液中逐滴加入0.1mol/L的盐酸,产生CO2的体积与所加盐酸体积之间的关系如图所示,下列说法正确的是( )| A. | 原溶液中NaOH的物质的量为0.75mol | |
| B. | 通入CO2后所得的溶液溶质成分为NaOH和Na2CO3 | |
| C. | 通入CO2后所得的溶液中含有2.5mol NaHCO3 | |
| D. | 原溶液通入CO2标准状况下为112mL |
20.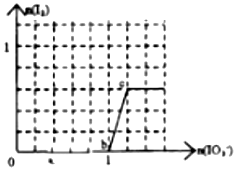 己知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法不正确的是( )
己知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法不正确的是( )
 己知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法不正确的是( )
己知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法不正确的是( )| A. | 0~a间发生反应:3HSO3-+IO3-═3SO42-+I-+3H+ | |
| B. | a~b间共消耗NaHSO3的物质的量为1.8mol | |
| C. | b~c间反应:I2仅是氧化产物 | |
| D. | 当溶液中I-与I2的物质的量之比为5:3时,加入的KIO3为1.1mol |
 .
.