题目内容
17.亚硝酸钠NaNO2与NH4Cl反应实验室常用制取N2,另生成两种常见化学物质.下列有关说法正确的是( )| A. | NaNO2是还原剂 | |
| B. | NH4Cl中N元素被还原 | |
| C. | 生成1 mol N2时转移6 mol 电子 | |
| D. | 氧化剂和还原剂的物质的量之比是1:1 |
分析 亚硝酸钠NaNO2与NH4Cl反应实验室常用制取N2,发生NaNO2+NH4Cl=NaCl+N2↑+2H2O,N元素的化合价由+3价降低为0,N元素的化合价由-3价升高为0,以此来解答.
解答 解:A.用NH4Cl和NaNO2反应制取N2,反应中NaNO2中+3价N化合价降低,被还原,所以在NaNO2反应中做氧化剂,故A错误;
B.用NH4Cl和NaNO2反应制取N2,反应中NH4Cl中的-3价N化合价升高,被氧化,故B错误;
C.由NaNO2+NH4Cl=NaCl+N2↑+2H2O,每生成1mol N2时,由化合价的变化可知,转移电子的物质的量为3mol,故C错误;
D.NaNO2中N元素的化合价由+3价降低为0,为氧化剂,NH4Cl中N元素的化合价由-3价升高为0,为还原剂,则氧化剂和还原剂的物质的量之比是1:1,故D正确;
故选D.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化及基本概念为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
7.某有机物的结构简式如图所示,关于它的叙述不正确的是( )
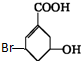

| A. | 该有机物的分子式为C7H9O3Br | |
| B. | 该有机物可使溴水褪色 | |
| C. | 该有机物可发生加成反应、消去反应、取代反应等 | |
| D. | 1mol该有机物与NaOH溶液反应时只能消耗1molNaOH |
8.已知25°C时,某浓度NaCN(氰化钠)溶液pH=11,则下列有关说法中不正确的是( )
| A. | HCN的电离方程式:HCN?H++CN- | |
| B. | NaCN是一种弱电解质 | |
| C. | NaCN溶液中一定存在:c(Na+)>c(CN-) | |
| D. | 0.1mol•L-1NaCN溶液中:c(CN-)+c(HCN)=0.1mol•L-1 |
5.下列物质与常用危险化学品的类别不对应的是( )
| A. | H2SO4----腐蚀品 | B. | CH4---易燃液体 | ||
| C. | 白磷---易自燃物品 | D. | HClO---氧化剂 |
12. 图用分类法表示了一些物质或概念之间的从属或包含关系,不正确的是( )
图用分类法表示了一些物质或概念之间的从属或包含关系,不正确的是( )
 图用分类法表示了一些物质或概念之间的从属或包含关系,不正确的是( )
图用分类法表示了一些物质或概念之间的从属或包含关系,不正确的是( )| X | Y | Z | |
| A | NaAlO2 | 盐 | 纯净物 |
| B | 胶体 | 分散系 | 混合物 |
| C | Al2O3 | 两性氧化物 | 氧化物 |
| D | 单质参与反应 | 置换反应 | 氧化还原反应 |
| A. | A | B. | B | C. | C | D. | D |
2.下列说法正确的是( )
| A. | SiO2溶于水显酸性 | |
| B. | CO2通入水玻璃中可得到硅酸 | |
| C. | SiO2是酸性氧化物,它不溶于任何酸 | |
| D. | SiO2在常温下不与任何物质反应 |
9.对于下列常见化学原理的认识错误 的是( )
| A. | 明矾可用作净水剂 | |
| B. | 酒精可用于杀菌、消毒 | |
| C. | 碳酸钙是陶瓷文物的主要成分 | |
| D. | 小苏打是一种膨松剂,可用于制作馒头和面包 |
6.下列关于能源和作为能源使用的物质的叙述中,错误的是( )
| A. | 化石燃料蕴藏的能量来自远古时期生物体所吸收利用的太阳能 | |
| B. | 太阳能不能直接转化为电能 | |
| C. | 物质的化学能可以在不同条件下转化为热能、电能等为人类所用 | |
| D. | 绿色植物发生光合作用时,将太阳能转化为化学能“贮存”起来 |
 CH4、NH3、H2O和HF均为含10e-的分子.
CH4、NH3、H2O和HF均为含10e-的分子.