题目内容
X、Y、Z、W均为短周期主族元素,表中为周期表的一部分.W原子的最外层电子数是其电子层数的2倍.下列说法正确的是( )
| X | Y | ||
| Z | W |
| A、通常情况下,X元素只存在两种氧化物 |
| B、Y元素气态氢化物的还原性最强 |
| C、X元素的非金属性比Y元素非金属性强 |
| D、W的最高价氧化物对应水化物的酸性比Z的强 |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、W均为短周期主族元素,由元素在周期表在位置可知,X、Y处于第二周期,Z、W处于第三周期,W原子的最外层电子数是其电子层数的2倍,最外层电子数为6,故W为S,则Z为Si,X为N、Y为F,结合元素周期律与元素化合物性质解答.
解答:
解:X、Y、Z、W均为短周期主族元素,由元素在周期表在位置可知,X、Y处于第二周期,Z、W处于第三周期,W原子的最外层电子数是其电子层数的2倍,最外层电子数为6,故W为S,则Z为Si,X为N、Y为F,
A.X为N元素,其氧化物有N2O、NO、N2O3、NO2、N2O4、N2O5,故A错误;
B.Y为氟元素,非金属性最强,故其氢化物还原性最弱,故B错误;
C.同周期自左而右非金属性增强,故Y的非金属性更强,故C错误;
D.非金属性W>Z,故W的最高价氧化物对应水化物的酸性比Z的强,故D正确,
故选D.
A.X为N元素,其氧化物有N2O、NO、N2O3、NO2、N2O4、N2O5,故A错误;
B.Y为氟元素,非金属性最强,故其氢化物还原性最弱,故B错误;
C.同周期自左而右非金属性增强,故Y的非金属性更强,故C错误;
D.非金属性W>Z,故W的最高价氧化物对应水化物的酸性比Z的强,故D正确,
故选D.
点评:本题考查结构性质位置关系应用,难度不大,注意对元素周期律的理解掌握.

练习册系列答案
相关题目
25℃时,将0.2mol?L-1的HF加水稀释过程中,下列表示的量保持不变的是( )
①n(H+); ②c(H+)?c(OH-);③c(OH-)+c(F-);④
⑤
.
①n(H+); ②c(H+)?c(OH-);③c(OH-)+c(F-);④
| c(H+) |
| c(HF) |
| c(H+)?c(F-) |
| c(HF) |
| A、①③④ | B、②③④ |
| C、③④⑤ | D、②⑤ |
下列垃圾中,不适合卫生填埋、焚烧、堆肥等处理方法的是( )
| A、厨余垃圾 | B、废电池 |
| C、植物秸秆 | D、织物垃圾 |
科学家刚刚发现了某种元素的一个原子,其质量是ag,12C的一个原子质量是bg,NA是阿伏伽德罗常数的值,下列说法正确的是( )
| A、该原子的摩尔质量是:aNA | ||
B、Wg该原子的物质的量是:
| ||
C、Wg该原子中含有
| ||
D、由已知信息可得:NA=
|
NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、7.8 gNa2O2与足量的水反应,转移的电子数为0.1NA |
| B、用含有0.1molFeCl3的饱和溶液制得的氢氧化铁胶体中,胶粒数等于0.1NA |
| C、25℃时,pH=13的1LBa(OH)2溶液中含有的OH-数为0.2NA |
| D、100mL 12 mol?L-1浓盐酸与足量MnO2加热反应,产生的氯气分子数为0.3NA |
 Ⅰ.已知:R-CH=CH-O-R′
Ⅰ.已知:R-CH=CH-O-R′ )的一条路线如图2:
)的一条路线如图2:
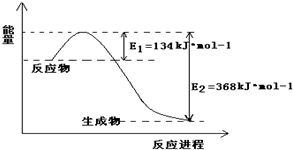 Ⅰ.(1)1molNO2和1molCO反应生成CO2和NO过程中的能量变化如图,请写出NO2和CO反应的热化学方程式
Ⅰ.(1)1molNO2和1molCO反应生成CO2和NO过程中的能量变化如图,请写出NO2和CO反应的热化学方程式
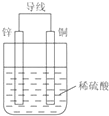 根据铜锌原电池示意图,回答下列问题:
根据铜锌原电池示意图,回答下列问题: