题目内容
等体积、等浓度的HCOONa和NaCN溶液,溶液中离子总数的关系正确的是(已知HCOOH比HCN易电离)( )
| A、HCOONa=NaCN |
| B、HCOONa>NaCN |
| C、HCOONa<NaCN |
| D、无法确定 |
考点:盐类水解的原理
专题:
分析:已知HCOOH比HCN易电离,则等体积、等浓度的HCOONa和NaCN溶液中CN-水解程度更大,结合溶液电荷守恒判断.
解答:
解:根据电荷守恒,c(HCOO-)+c(OH-)=c(Na+)+c(H+),c(CN-)+c(OH-)=c(Na+)+c(H+),即离子总数是n(Na+ )+n(H+)的2倍,
而NaCN的水解程度大,即NaCN溶液中的c(OH-)大,c(H+)小,c(Na+)相同,所以甲酸钠中离子浓度大,
故选B.
而NaCN的水解程度大,即NaCN溶液中的c(OH-)大,c(H+)小,c(Na+)相同,所以甲酸钠中离子浓度大,
故选B.
点评:本题考查盐类的水解,为高频考点,侧重于学生的分析能力的考查,注意把握水解的程度,从溶液电中性的角度解答该题,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列图示与对应的叙述相符的是( )
A、 如图表示盐酸滴加到0.1mol/L某碱溶液得到的滴定曲线,用已知浓度盐酸滴定未知浓度该碱时最好选取酚酞作指示剂 |
B、 如图表示一定条件下进行的反应2SO2+O2═2SO3各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积 |
C、 如图表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20mL Ba(OH)2溶液时铝离子恰好沉淀完全 |
D、 如图表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是盐酸 |
X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15;X与Z可形成XZ2型分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L,W的质子数是X、Y、Z、M四种元素质子数之和的
.下列说法正确的是( )
| 1 |
| 2 |
| A、原子半径:W>Z>Y>X>M |
| B、XZ2、X2M2、W2Z2均为共价化合物 |
| C、由X元素形成的单质不一定能导电 |
| D、由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
某无色溶液中加入氯化钡后有白色沉淀,再加稀硝酸沉淀不消失,则该溶液中( )
| A、一定含有SO42- |
| B、一定含有Ag+ |
| C、可能含有SO42-或Ag+ |
| D、一定含有Ag+、SO42- |
CaC2是离子型金属碳化物,容易发生水解反应,生成乙炔和氢氧化钙.现有ZnC2、Al4C3、Mg2C3、Li2C2等,同属于离子型金属碳化物,也很容易发生水解反应.请从CaC2跟H2O反应生成C2H2的反应过程进行思考,从中得到必要的启示,判断下列物质的水解产物是C3H4的是( )
| A、ZnC2 |
| B、Al4C3 |
| C、Mg2C3 |
| D、Li2C2 |
25℃时,将0.2mol?L-1的HF加水稀释过程中,下列表示的量保持不变的是( )
①n(H+); ②c(H+)?c(OH-);③c(OH-)+c(F-);④
⑤
.
①n(H+); ②c(H+)?c(OH-);③c(OH-)+c(F-);④
| c(H+) |
| c(HF) |
| c(H+)?c(F-) |
| c(HF) |
| A、①③④ | B、②③④ |
| C、③④⑤ | D、②⑤ |
科学家刚刚发现了某种元素的一个原子,其质量是ag,12C的一个原子质量是bg,NA是阿伏伽德罗常数的值,下列说法正确的是( )
| A、该原子的摩尔质量是:aNA | ||
B、Wg该原子的物质的量是:
| ||
C、Wg该原子中含有
| ||
D、由已知信息可得:NA=
|
 Ⅰ.已知:R-CH=CH-O-R′
Ⅰ.已知:R-CH=CH-O-R′ )的一条路线如图2:
)的一条路线如图2:
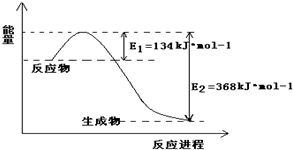 Ⅰ.(1)1molNO2和1molCO反应生成CO2和NO过程中的能量变化如图,请写出NO2和CO反应的热化学方程式
Ⅰ.(1)1molNO2和1molCO反应生成CO2和NO过程中的能量变化如图,请写出NO2和CO反应的热化学方程式