题目内容
苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是:C8H10(g)?C8H8(g)+H2(g)△H=120kJ?mol-1
某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内气体物质的量,得到数据如下表:
(1)当反应进行到20min时,该段时间内H2的平均反应速率是 .
(2)该温度下,该反应的化学平衡常数是 .
(3)若保持其他条件不变,用0.50mol H2(g)和0.50mol C8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是 .此时,该合成反应是否达到了平衡状态? (填“是”或“否”),且正反应速率 逆反应速率(填大于、小于或等于)
(4)对于反应C8H10(g)?C8H8(g)+H2(g),下列说法正确的是
A、恒温恒容条件下C8H10(g)和C8H8(g)生成速率相等能说明该反应达到平衡状态
B、压强增大该反应的平衡常数也增大
C、在恒温恒压条件下,有2mol C8H10(g)在容器中完全反应,该反应的反应热为△H1,另有4mol C8H10(g)在容器中完全反应,该反应的反应热为△H2,则△H2=2△H1.
某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内气体物质的量,得到数据如下表:
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(C8H10)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
| n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
(2)该温度下,该反应的化学平衡常数是
(3)若保持其他条件不变,用0.50mol H2(g)和0.50mol C8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是
(4)对于反应C8H10(g)?C8H8(g)+H2(g),下列说法正确的是
A、恒温恒容条件下C8H10(g)和C8H8(g)生成速率相等能说明该反应达到平衡状态
B、压强增大该反应的平衡常数也增大
C、在恒温恒压条件下,有2mol C8H10(g)在容器中完全反应,该反应的反应热为△H1,另有4mol C8H10(g)在容器中完全反应,该反应的反应热为△H2,则△H2=2△H1.
考点:化学平衡的计算
专题:
分析:(1)根据v=
计算;
(2)30min到40min时,n(C8H8)不再变化,说明30min时反应达到平衡状态,根据平衡常数计算公式计算;
(3)转化率=
×100%;根据
和平衡常数K比较大小,判断平衡移动方向;
(4)A、恒温恒容条件下C8H10(g)和C8H8(g)生成速率相等,说明正逆反应速率相等,该反应达到平衡状态;
B、平衡常数只与温度有关,压强增大该反应的平衡常数不变;
C、反应热只与反应物和生成物有关,和量无关.
| △c |
| △t |
(2)30min到40min时,n(C8H8)不再变化,说明30min时反应达到平衡状态,根据平衡常数计算公式计算;
(3)转化率=
| 消耗量 |
| 起始量 |
| c(C8H10) |
| c(C8H8)c(H2) |
(4)A、恒温恒容条件下C8H10(g)和C8H8(g)生成速率相等,说明正逆反应速率相等,该反应达到平衡状态;
B、平衡常数只与温度有关,压强增大该反应的平衡常数不变;
C、反应热只与反应物和生成物有关,和量无关.
解答:
解:(1)将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,20min后,剩余0.24mol,减少了0.16mol,
C8H10(g)?C8H8(g)+H2(g)
起始(mol) 0.40 0 0
变化(mol) 0.16 0.16 0.16
20min(mol) 0.24 0.16 0.16
v(H2)=
=
=0.004mol/(L?min)
故答案为:0.004mol/(L?min);
(2)C8H10(g)?C8H8(g)+H2(g)
起始(mol/L) 0.20 0 0
变化(mol/L) 0.10 0.10 0.10
30min(mol/L) 0.10 0.10 0.10
化学平衡常数K=
=
=0.1;
故答案为:0.1;
(3)根据C8H10(g)?C8H8(g)+H2(g)△H=120kJ?mol-1,可知 C8H8(g)+H2(g)?C8H10(g)△H=-120kJ?mol-1,有30kJ热量放出时,消耗的H2量为0.25mol,所以氢气转化率=
×100%=
×100%=50%;
根据(2)计算平衡常数=0.1,知 C8H8(g)+H2(g)?C8H10(g)的平衡常数为10,
C8H8(g)+H2(g)?C8H10(g)
起始(mol/L) 0.25 0.25 0
变化(mol/L) 0.125 0.125 0.125
某时刻(mol/L) 0.125 0.125 0.125
=
=8<10,反应未达平衡状态,向正方向移动,正反应速率大于逆反应速率;
故答案为:50%;否;大于;
(4)对于反应C8H10(g)?C8H8(g)+H2(g),
A、恒温恒容条件下C8H10(g)和C8H8(g)生成速率相等,说明正逆反应速率相等,该反应达到平衡状态,故A正确;
B、平衡常数只与温度有关,压强增大该反应的平衡常数不变,故B错误;
C、反应热只与反应物和生成物有关,和量无关,故C错误.
故答案为:A.
C8H10(g)?C8H8(g)+H2(g)
起始(mol) 0.40 0 0
变化(mol) 0.16 0.16 0.16
20min(mol) 0.24 0.16 0.16
v(H2)=
| △c |
| △t |
| ||
| 20min |
故答案为:0.004mol/(L?min);
(2)C8H10(g)?C8H8(g)+H2(g)
起始(mol/L) 0.20 0 0
变化(mol/L) 0.10 0.10 0.10
30min(mol/L) 0.10 0.10 0.10
化学平衡常数K=
| c(C8H8)?c(H2) |
| c(C8H10) |
| 0.10×0.10 |
| 0.10 |
故答案为:0.1;
(3)根据C8H10(g)?C8H8(g)+H2(g)△H=120kJ?mol-1,可知 C8H8(g)+H2(g)?C8H10(g)△H=-120kJ?mol-1,有30kJ热量放出时,消耗的H2量为0.25mol,所以氢气转化率=
| 消耗量 |
| 起始量 |
| 0.25mol |
| 050mol |
根据(2)计算平衡常数=0.1,知 C8H8(g)+H2(g)?C8H10(g)的平衡常数为10,
C8H8(g)+H2(g)?C8H10(g)
起始(mol/L) 0.25 0.25 0
变化(mol/L) 0.125 0.125 0.125
某时刻(mol/L) 0.125 0.125 0.125
| c(C8H10) |
| c(C8H8)c(H2) |
| 0.125 |
| 0.125×0.125 |
故答案为:50%;否;大于;
(4)对于反应C8H10(g)?C8H8(g)+H2(g),
A、恒温恒容条件下C8H10(g)和C8H8(g)生成速率相等,说明正逆反应速率相等,该反应达到平衡状态,故A正确;
B、平衡常数只与温度有关,压强增大该反应的平衡常数不变,故B错误;
C、反应热只与反应物和生成物有关,和量无关,故C错误.
故答案为:A.
点评:本题考查化学平衡有关计算问题,题目难度中等,本题易错点为(4),注意平衡常数只与温度有关.

练习册系列答案
相关题目
下列物质中,不属于合成材料的是( )
| A、塑料 | B、棉花 |
| C、合成纤维 | D、合成橡胶 |
下列相关实验示意图不能达到实验目的是( )
A、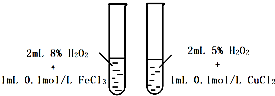 探究不同催化剂对H2O2分解速率影响 |
B、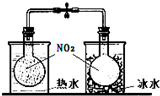 探究温度对2NO2?N2O4平衡影响 |
C、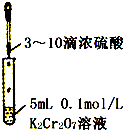 验证Cr2O72-+H2O?2CrO42-+2H+平衡状态变化 |
D、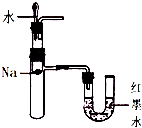 验证钠和水反应的热效应 |
下列说法中,正确的是( )
| A、反应产物的总能量大于反应物的总能量时,△H<0 |
| B、在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 |
| C、△H<0、△S>0的反应在温度低时不能自发进行 |
| D、一个化学反应的△H仅与反应的起始状态和反应的最终状态有关,与反应途径无关 |