题目内容
室温下,pH=2的某酸HnA(A为酸根)与pH=12的某碱B(OH)m等体积混合,混合液的pH变为8
(1)写出生成正盐的化学式 ;
(2)该盐中存在着一定能水解的离子,该离子水解的离子方程式为 ;
(3)简述该混合液呈碱性的原因.
(1)写出生成正盐的化学式
(2)该盐中存在着一定能水解的离子,该离子水解的离子方程式为
(3)简述该混合液呈碱性的原因.
考点:pH的简单计算
专题:电离平衡与溶液的pH专题
分析:pH=2的某酸HnA(A为酸根)与pH=12的某碱B(OH)m等体积混合生成正盐,说明酸中氢离子的总物质的量和碱中氢氧根离子的总物质的量相等,其盐溶液呈碱性,说明碱的电离程度大于酸的电离程度,根据化合物中化合价的代数和为0确定其化学式,根据酸碱的相对强弱确定水解的离子.
解答:
解:(1)HnA中A的化合价是-n价,B(OH)m中B的化合价是+m价,根据化合物中化合价的代数和为0知,二者的离子个数之比为n:m,则其化学式为:BnAm,
故答案为:BnAm;
(2)根据题意知,其正盐溶液呈碱性,说明碱的电离程度大于酸的电离程度,生成的盐是强碱弱酸盐,则An-离子一定能水解,其水解方程式为:An-+H2O?HA(n-1)-+OH-,
故答案为:An-+H2O?HA(n-1)-+OH-;
(3)该溶液呈碱性的原因是An-的水解,
答:该混合液呈碱性的原因是An-的水解.
故答案为:BnAm;
(2)根据题意知,其正盐溶液呈碱性,说明碱的电离程度大于酸的电离程度,生成的盐是强碱弱酸盐,则An-离子一定能水解,其水解方程式为:An-+H2O?HA(n-1)-+OH-,
故答案为:An-+H2O?HA(n-1)-+OH-;
(3)该溶液呈碱性的原因是An-的水解,
答:该混合液呈碱性的原因是An-的水解.
点评:本题考查了酸碱混合溶液定性判断,明确“谁强谁显性、谁弱谁水解”即可解答,并结合化合物中化合价的代数和为0进行分析,难度中等.

练习册系列答案
相关题目
下列关于塑料的叙述错误的是( )
| A、塑料是聚合物 |
| B、CH2=CH-CH3是聚乙烯的单体 |
| C、塑料的主要成分是合成树脂 |
| D、塑料可以分为热固性和热塑性 |
 容积均为500 mL的Ⅰ,Ⅱ,Ⅲ三个密闭容器(容器体积恒定不变)中分别充入1 mol N2和2.5 mol H2,三个容器的反应温度分别为T1,T2,T3且恒定不变,在其他条件相同的情况下发生反应:N2+3H2?2NH3(△H<0).实验测得反应均进行到t min时N2的体积分数如图所示.下列说法正确的是( )
容积均为500 mL的Ⅰ,Ⅱ,Ⅲ三个密闭容器(容器体积恒定不变)中分别充入1 mol N2和2.5 mol H2,三个容器的反应温度分别为T1,T2,T3且恒定不变,在其他条件相同的情况下发生反应:N2+3H2?2NH3(△H<0).实验测得反应均进行到t min时N2的体积分数如图所示.下列说法正确的是( )| A、当v(H2)=3v(N2)时,可以说明三个容器中的反应达平衡状态 |
| B、在t min时,一定达化学平衡状态的是Ⅱ和Ⅲ |
| C、在t min时测得c(N2)Ⅲ=1 mol/L,若再向Ⅲ中充入1.5 mol N2和1 mol NH3,H2的转化率不变 |
| D、三个容器中的反应均达到平衡后,容器I中混合气体的平均相对分子质量最小 |
光导纤维的主要成分是( )
| A、硅 | B、玻璃 | C、二氧化硅 | D、沙子 |
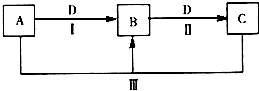 A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素.在一定条件下相互转化关系如图所示(部分产物已略去).
A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素.在一定条件下相互转化关系如图所示(部分产物已略去).