题目内容
3.与100mL0.1mol/LNa2SO4溶液中Na+离子浓度相同的是( )| A. | 10mL1mol/LNa2SO4溶液 | B. | 50mL0.2mol/LNaCl溶液 | ||
| C. | 10mL0.2mol/LNa2SO4溶溶液 | D. | 200mL0.1mol/LNaNO3溶液 |
分析 溶液中Na+离子浓度与溶液体积大小无关,与溶质的物质的量浓度及溶质化学式组成有关,据此进行解答.
解答 解:100mL0.1mol/LNa2SO4溶液中Na+离子浓度为:0.1mol/L×2=0.2mol/L,
A.10mL1mol/LNa2SO4溶液中Na+离子浓度为:1mol/L×1=2mol/L,故A错误;
B.10mL1mol/LNa2SO4溶液中Na+离子浓度为:0.2mol/L×1=0.2mol/L,故B正确;
C.10mL0.2mol/LNa2SO4溶溶液中Na+离子浓度为:0.2mol/L×2=0.4mol/L,故C错误;
D.200mL0.1mol/LNa2NO3溶液中Na+离子浓度为:0.1mol/L×1=0.1mol/L,故D错误;
故选B.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量浓度的概念及表达式为解答关键,试题侧重基础知识的考查,有利于提高学生的分析能力及化学计算能力.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
4.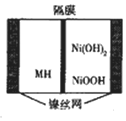 一种新型金属氢化物镍电池(MH-Ni电池,MH为贮氢材料)工作原理如图所示.下列有关说法正确的是( )
一种新型金属氢化物镍电池(MH-Ni电池,MH为贮氢材料)工作原理如图所示.下列有关说法正确的是( )
 一种新型金属氢化物镍电池(MH-Ni电池,MH为贮氢材料)工作原理如图所示.下列有关说法正确的是( )
一种新型金属氢化物镍电池(MH-Ni电池,MH为贮氢材料)工作原理如图所示.下列有关说法正确的是( )| A. | 隔膜为阴离子交换膜 | |
| B. | 电池的电解液可为硫酸 | |
| C. | 充电时阳极反应为H2O+M+e-═MH+OH- | |
| D. | 放电时负极反应为Ni(OH)2+OH--e-═NiOOH+H2O |
14.下列物质与其可造成的环境污染,关系不正确的是( )
| A. | CO2--温室效应 | B. | NO2--光化学烟雾 | C. | SO2--酸雨 | D. |  ---白色污染 ---白色污染 |
18.下列的分离方法不正确的是( )
| A. | 用过滤的方法除去食盐中的泥沙 | |
| B. | 用蒸馏的方法将自来水制成蒸馏水 | |
| C. | 用酒精萃取溴水中的溴 | |
| D. | 用蒸发浓缩、降温结晶、过滤的方法从硝酸钾和氯化钠的混合溶液中获得硝酸钾晶体 |
8.大量生产金属单质铁和铝的方法是( )
| A. | 加热法和还原法 | B. | 还原法和加热法 | C. | 还原法和电解法 | D. | 电解法和还原法 |
15.X、Y为两种主族元素,其原子的最外层电子数分别为1和6,则X、Y两种元素形成的化合物( )
| A. | 一定是离子化合物 | |
| B. | 一定是共价化合物 | |
| C. | 一定形成X2Y型化合物 | |
| D. | 可能含有离子键、极性键、非极性键中的一种或两种 |
12.将混有少量泥沙的碘的混合物分离最佳方法是( )
| A. | 将混合物溶于水 | B. | 将混合物加热使碘升华 | ||
| C. | 将混合物倒入NaOH溶液 | D. | 将混合物倒入酒精中充分溶解 |
13.化学与生活密切相关,下列选项不正确的是( )
| A. | 84消毒液的有效成分是NaClO | |
| B. | 装饰材料释放的甲醛会造成污染 | |
| C. | 高纯硅广泛应用于太阳能电池和计算机芯片 | |
| D. | 食品/保鲜膜、塑料水杯等生活用品的主要成分是聚氯乙烯 |
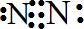 ;将空气中的氮气转化为氮的化合物的过程称为固氮,下列能实现人工固氮的是D
;将空气中的氮气转化为氮的化合物的过程称为固氮,下列能实现人工固氮的是D