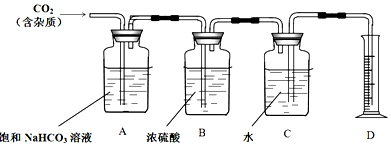
题目内容
18.下列的分离方法不正确的是( )| A. | 用过滤的方法除去食盐中的泥沙 | |
| B. | 用蒸馏的方法将自来水制成蒸馏水 | |
| C. | 用酒精萃取溴水中的溴 | |
| D. | 用蒸发浓缩、降温结晶、过滤的方法从硝酸钾和氯化钠的混合溶液中获得硝酸钾晶体 |
分析 A.泥沙不溶于水;
B.水易挥发、液化;
C.酒精易溶于水;
D.硝酸钾和氯化钠的沸点随温度变化不同.
解答 解:A.泥沙不溶于水,可用过滤的方法除杂,故A正确;
B.水易挥发、液化,可用蒸馏的方法制备蒸馏水,故B正确;
C.酒精易溶于水,不能用于萃取剂,故C错误;
D.硝酸钾和氯化钠的沸点随温度变化不同,温度变化时硝酸钾的溶解度变化较大,硝酸钾和氯化钠的混合溶液中获得硝酸钾晶体,可用蒸发浓缩、降温结晶的方法,故D正确.
故选C.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、发生的反应、混合物分离方法为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
9.类比是化学学习中常用的方法,已知硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是Fe(NO3)2.某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当Cl2足量时生成FeCl3,当铁粉过量时产物是FeCl2,为验证该观点是否正确,该同学将一定量的铁粉与Cl2恰好完全反应得到一固体物质,然后通过实验确定其成分.探究过程如下:
请填空:
(1)提出假设:
假设1:该固体物质是FeCl2
假设2:该固体物质是FeCl3
假设3:该固体物质是FeCl3和FeCl2的混合物
(2)设计实验方案:
取少量固体物质于烧杯中,加适量水溶解,得到溶液A,然后取两份A溶液分别进行实验,实验现象与结论如表:
(3)根据上述实验结论,写出Cl2与铁粉加热时发生反应的化学方程式2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3.
(4)为进一步探究FeCl3溶液的性质,他又利用A溶液做了如下一些实验,其中明显错误的是D.
A.将A溶液滴入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔效应
B.在A溶液中加入淀粉KI溶液,溶液变蓝色
C.在A溶液中滴加NaOH浓溶液,出现红褐色沉淀
D.将A溶液中热蒸干并灼烧,得到FeCl3固体
(5)已知25℃时Ksp=4.0×10-38,此温度下若在实验室中配制5mol/L l00mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入2.5 mL 2mol/L的盐酸(忽略加入盐酸体积).加入盐酸的目的是:抑制氯化铁水解.
请填空:
(1)提出假设:
假设1:该固体物质是FeCl2
假设2:该固体物质是FeCl3
假设3:该固体物质是FeCl3和FeCl2的混合物
(2)设计实验方案:
取少量固体物质于烧杯中,加适量水溶解,得到溶液A,然后取两份A溶液分别进行实验,实验现象与结论如表:
| 实验方法 | 实验现象 | 结论 |
| 在溶液中加KSCN溶液 | 溶液变红色 | 固体物质中有FeCl3 |
| 在酸性KMnO4溶液中加少量A溶液 | KMnO4溶液颜色无明显变化 | 固体物质中不含FeCl2 |
(4)为进一步探究FeCl3溶液的性质,他又利用A溶液做了如下一些实验,其中明显错误的是D.
A.将A溶液滴入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔效应
B.在A溶液中加入淀粉KI溶液,溶液变蓝色
C.在A溶液中滴加NaOH浓溶液,出现红褐色沉淀
D.将A溶液中热蒸干并灼烧,得到FeCl3固体
(5)已知25℃时Ksp=4.0×10-38,此温度下若在实验室中配制5mol/L l00mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入2.5 mL 2mol/L的盐酸(忽略加入盐酸体积).加入盐酸的目的是:抑制氯化铁水解.
6.下列反应中硝酸既表现出了强氧化性又表现了酸性的是( )
| A. | 氧化铁与硝酸反应 | B. | 氢氧化铜与硝酸反应 | ||
| C. | 木炭粉与浓硝酸反应 | D. | 铜与硝酸反应 |
3.与100mL0.1mol/LNa2SO4溶液中Na+离子浓度相同的是( )
| A. | 10mL1mol/LNa2SO4溶液 | B. | 50mL0.2mol/LNaCl溶液 | ||
| C. | 10mL0.2mol/LNa2SO4溶溶液 | D. | 200mL0.1mol/LNaNO3溶液 |
10.下列有关物质性质的比较顺序中,不正确的是( )
| A. | 热稳定性:HF<HCl<HBr<HI | B. | 微粒半径:K+>Na+>Mg2+>Al3+ | ||
| C. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 | D. | 最外层电子数Li<Mg<Si<Ar |
7.在3Cl2+6KOH→KClO3+5KCl+3H2O的反应中,被氧化的氯元素与被还原的氯元素的质量之比为( )
| A. | 2:1 | B. | 5:1 | C. | 1:1 | D. | 1:5 |
 下面是某同学学习硫元素的学习方案.
下面是某同学学习硫元素的学习方案.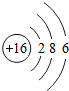 ,从结构知道硫元素是一种典型非金属元素.
,从结构知道硫元素是一种典型非金属元素.