题目内容
4.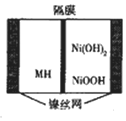 一种新型金属氢化物镍电池(MH-Ni电池,MH为贮氢材料)工作原理如图所示.下列有关说法正确的是( )
一种新型金属氢化物镍电池(MH-Ni电池,MH为贮氢材料)工作原理如图所示.下列有关说法正确的是( )| A. | 隔膜为阴离子交换膜 | |
| B. | 电池的电解液可为硫酸 | |
| C. | 充电时阳极反应为H2O+M+e-═MH+OH- | |
| D. | 放电时负极反应为Ni(OH)2+OH--e-═NiOOH+H2O |
分析 镍氢电池中主要为KOH作电解液充电时,阳极反应:Ni(OH)2+OH--e-=NiOOH+H2O,阴极反应:M+H2O+e-=MH+OH-,总反应:M+Ni(OH)2=MH+NiOOH;
放电时,正极:NiOOH+H2O+e-=Ni(OH)2+OH-,负极:MH+OH-=M+H2O+e-,总反应:MH+NiOOH=M+Ni(OH)2 ,据此分析解答.
解答 解:A、充电时,阳极反应:Ni(OH)2+OH-=NiOOH+H2O+e-,则充电时氢氧根离子移向阳极,要参与电极反应,所以隔膜为阴离子交换膜,故A正确;
B、镍氢电池中主要为KOH作电解液,故B错误;
C、充电时,阳极反应:Ni(OH)2+OH--e-=NiOOH+H2O,故C错误;
D、放电时负极上MH失电子,负极反应为:MH+OH--e-=M+H2O,故D错误;
故选A.
点评 本题考查了原电池和电解池原理,明确题给信息的含义是解本题关键,难点的电极反应式的书写,题目难度中等.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
15.设 NA 为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 常温常压下,28 g CO 和 C2H4混合气体中的碳原子数为 NA | |
| B. | 1 mol N2 与 3 mol H2 充分反应,产物的分子数为 2NA | |
| C. | 标准状况下,11.2 L 己烷中含有的碳碳键数为 2.5NA | |
| D. | 32 g 硫粉与足量的 Cu 粉完全反应,转移的电子数为 2NA |
12. 如图所示是一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池,该固体氧化物电解质在700-900℃温度时,O2-可在该固体氧化物电解质中自由移动,电池反应生成均为无毒无害的物质,下列说法正确的是( )
如图所示是一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池,该固体氧化物电解质在700-900℃温度时,O2-可在该固体氧化物电解质中自由移动,电池反应生成均为无毒无害的物质,下列说法正确的是( )
 如图所示是一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池,该固体氧化物电解质在700-900℃温度时,O2-可在该固体氧化物电解质中自由移动,电池反应生成均为无毒无害的物质,下列说法正确的是( )
如图所示是一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池,该固体氧化物电解质在700-900℃温度时,O2-可在该固体氧化物电解质中自由移动,电池反应生成均为无毒无害的物质,下列说法正确的是( )| A. | 电池内的由O2-电极乙移向电极甲 | |
| B. | 电池的总反应为:N2H4+2O2═2NO+2H2O | |
| C. | 当甲电极上有1molN2H4消耗时,乙电极上有1molO2被氧化 | |
| D. | 电池外电路的电子由电极乙移向电极甲 |
9.《中国诗词大会》不仅弘扬了中国传统文化,还蕴含着许多化学知识,下列诗词分析不正确的是(
| A. | 李白诗句“日照香炉生紫烟,遥看瀑布挂前川”,“紫烟”指“香炉”中碘升华的现象 | |
| B. | 刘禹锡诗句“千淘万漉虽辛苦,吹尽狂沙始到金”,金性质稳定,可通过物理方法得到 | |
| C. | 王安石诗句“爆竹声中一岁除,春风送暖入屠苏”,爆竹的燃放涉及氧化还原反应 | |
| D. | 曹植诗句“煮豆燃豆萁,豆在釜中泣”,这里的能量变化主要是化学能转化为热能 |
16.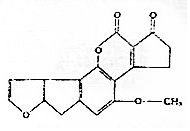 黄曲霉素AFTB1,其结构简式如图所示.它是污染粮食的真菌霉素,人类的P53特殊基因在黄曲霉素的作用下会发生突变,有引发肝癌的可能性.下列说法正确的是( )
黄曲霉素AFTB1,其结构简式如图所示.它是污染粮食的真菌霉素,人类的P53特殊基因在黄曲霉素的作用下会发生突变,有引发肝癌的可能性.下列说法正确的是( )
 黄曲霉素AFTB1,其结构简式如图所示.它是污染粮食的真菌霉素,人类的P53特殊基因在黄曲霉素的作用下会发生突变,有引发肝癌的可能性.下列说法正确的是( )
黄曲霉素AFTB1,其结构简式如图所示.它是污染粮食的真菌霉素,人类的P53特殊基因在黄曲霉素的作用下会发生突变,有引发肝癌的可能性.下列说法正确的是( )| A. | 黄曲霉素分子中所有的原子均共面 | |
| B. | 黄曲霉素分子中含有2个手性碳原子 | |
| C. | 黄曲霉素可以发生取代,加成,氧化反应 | |
| D. | 1mol黄曲霉素最多能与7molH2发生加成反应 |
2.下列说法不正确的是( )
| A. | 核外电子排布为1s22s22p43s2的原子处于激发态 | |
| B. | 某元素质量数51,中子数28,其基态原子中未成对电子数为1 | |
| C. | 若某基态原子的外围电子排布为4d15s2,该元素原子核外有5个电子层 | |
| D. | BF3中B原子sp2杂化,为平面三角形 |
3.与100mL0.1mol/LNa2SO4溶液中Na+离子浓度相同的是( )
| A. | 10mL1mol/LNa2SO4溶液 | B. | 50mL0.2mol/LNaCl溶液 | ||
| C. | 10mL0.2mol/LNa2SO4溶溶液 | D. | 200mL0.1mol/LNaNO3溶液 |
 .
.