题目内容
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环。下列说法不正确的是
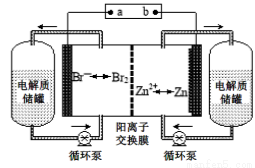
A.阳离子交换膜可阻止Br2与Zn直接发生反应
B.放电时负极的电极反应式为Zn-2e-=Zn2+
C.充电时电极a连接电源的负极
D.放电时左侧电解质储罐中的离子总浓度增大
C
【解析】
试题分析:A、阳离子交换膜制允许阳离子通过,所以阳离子交换膜可阻止Br2与Zn直接发生反应,A正确;B、锌是活泼的金属,作负极,失去电子,电极反应式为Zn-2e-=Zn2+,B正确;C、a是正极,则充电时电极a连接电源的正极,C错误;D、放电时左侧是负极,锌失去电子转化为锌离子,所以电解质储罐中的离子总浓度增大,D正确,答案选C。
考点:考查电化学原理的应用

(16分)Ⅰ.用中和滴定法测定某烧碱样品的纯度。(锥形瓶中装待测液)配制待测液:将2.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制200mL溶液。
(1)滴定:盛装0.20mol/L盐酸标准液应该用酸式滴定管;滴定时,先向盛待测液的锥形瓶中加酚酞作为指示剂;滴定终点的现象是:_____________________________
(2)有关数据记录如下:
滴定序号 | 待测液体积(ml) | 所消耗盐酸标准液的体积(ml) | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.50 | 20.55 |
2 | 20.00 | 6.00 | 25.95 |
纯度计算:烧碱样品的纯度为________________。
(3)对几种假定情况的讨论:(填无影响、偏高、偏低)(测定的结果指烧碱溶液的浓度)
①若用蒸馏水冲洗锥形瓶,则会使测定的结果___________________
②若滴定前用蒸馏水冲洗酸式滴定管后即装标准盐酸,则会使测定结果__________
③滴加盐酸时未充分振荡,刚看到溶液变色,立刻停止滴定,则会使测定结果________。
Ⅱ.现有室温下浓度均为1×10-3 mol/L的几种溶液:①盐酸、②硫酸、③醋酸、④NaOH溶液,回答下列问题:
(1)将③、④混合后,若溶液呈中性,则消耗两溶液的体积为③________④(填“>”、“<”或“=”)。溶液中的离子浓度由大到小的顺序为________________。
(2)向相同体积的①、②、③溶液中分别加入相同的且足量的锌粒,反应的初始速率由快到慢的顺序为___________,(填序号)最终产生H2总量的关系为___________(填序号)
(3)向相同体积的①、③溶液中分别加入相同浓度、相同体积的CH3COONa溶液,充分混合后,混合液的pH大小关系为①_________③(填“>”、“<”或“=”)
(10分)工业上利用电解污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金属,回收流程如下:
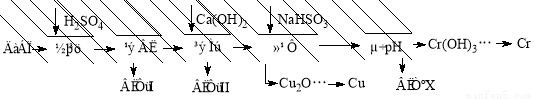
已知部分物质沉淀的pH及CaSO4的溶解度曲线如下:
Fe3+ | Cu2+ | Cr3+ | |
开始沉淀pH | 2.1 | 4.7 | 4.3 |
完全沉淀pH | 3.2 | 6.7 | a |

(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有 。
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:①加入石灰乳调节pH范围为: ~ ;②将浊液加热到80℃, 。
(3)写出还原步骤中加入NaHSO3生成Cu2O固体的离子反应方程式 ,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是 。
(12分)某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示。

(1)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验。
步骤① | 配制1 mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管B中,加热A。 |
FeCl3溶液显酸性的原因是_________。写出装置A中产生SO2的化学方程式:_________。
(2)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象。将混合液放置12小时,溶液才变成浅绿色。
【查阅资料】 Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+。生成Fe(HSO3)2+离子的反应为可逆反应。
解释SO2与FeCl3溶液反应生成红棕色Fe(HSO3)2+离子的原因:_____________________。
写出溶液中Fe(HSO3)2+离子与Fe3+反应的离子方程式:______________________________。
(3)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了步骤③的实验。
步骤② | 往5mL1mol·L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶液颜色变为浅绿色。 |
步骤③ | 往5mL重新配制的1mol·L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色。 |
用铁氰化钾溶液检验步骤②和步骤③所得溶液中的Fe2+,其现象为_______________。
(4)综合上述实验探究过程,可以获得的实验结论:
I.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
II.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
III._________________________________。

