��Ŀ����
��12�֣�ijУ��ѧ��ȤС��̽��SO2��FeCl3��Һ�ķ�Ӧ������װ������ͼ��ʾ��

��1����С��ͬѧԤ��SO2��FeCl3��Һ��Ӧ������Ϊ��Һ���ػ�ɫ���dz��ɫ��Ȼ��ʼʵ�顣
����� | ����1 mol��L-1 FeCl3��Һ��δ�������ữ��������pHԼΪ1��ȡ����װ���Թ�B�У�����A�� |
FeCl3��Һ�����Ե�ԭ����_________��д��װ��A�в���SO2�Ļ�ѧ����ʽ��_________��
��2����SO2ͨ�뵽FeCl3��Һ������ʱ��ͬѧ�ǹ۲쵽����������Һ���ػ�ɫ��ɺ���ɫ��û�й۲쵽������������Һ����12Сʱ����Һ�ű��dz��ɫ��
���������ϡ� Fe(HSO3)2+����Ϊ����ɫ�������Խ�Fe3+��ԭΪFe2+������Fe(HSO3)2+���ӵķ�ӦΪ���淴Ӧ��
����SO2��FeCl3��Һ��Ӧ���ɺ���ɫFe(HSO3)2+���ӵ�ԭ��_____________________��
д����Һ��Fe(HSO3)2+������Fe3+��Ӧ�����ӷ���ʽ��______________________________��
��3��Ϊ��̽��������̺���ɫ��Ϊdz��ɫ��ʱ�䣬��С��ͬѧ�����˲���۵�ʵ�顣
����� | ��5mL1mol��L-1 FeCl3��Һ��ͨ��SO2���壬��Һ������Ϊ����ɫ����3 min����Һ��ɫ��Ϊdz��ɫ�� |
����� | ��5mL�������Ƶ�1mol��L-1 FeCl3��Һ����Ũ�����ữ����ͨ��SO2���壬��Һ������Ϊ����ɫ�������Ӻ�����Һ��ɫ���dz��ɫ�� |
�����軯����Һ���鲽��ںͲ����������Һ�е�Fe2+��������Ϊ_______________��
��4���ۺ�����ʵ��̽�����̣����Ի�õ�ʵ����ۣ�
I��SO2��FeCl3��Һ��Ӧ���ɺ���ɫ�м����Fe(HSO3)2+���ӣ�
II������ɫ�м����ת���dz��ɫ��Һ��һ�������Ĺ��̣�
III��_________________________________��
��10�֣�δ������Ŀգ�ÿ��1�֣���1��Fe3++ 3H2O Fe(OH)3+ 3H+
Fe(OH)3+ 3H+
Cu + 2H2SO4(Ũ) CuSO4 + SO2��+2H2O��2�֣�
CuSO4 + SO2��+2H2O��2�֣�
��2��H2O + SO2 H2SO3��H2SO3
H2SO3��H2SO3  H++HSO3����1�֣�Fe3++HSO3��
H++HSO3����1�֣�Fe3++HSO3�� Fe(HSO3)2+��1�֣�����2�֣�
Fe(HSO3)2+��1�֣�����2�֣�
Fe3+ + H2O + Fe(HSO3)2+��2Fe2+ + SO42�� + 3H+��2�֣� ��3��������ɫ����
��4�����ȡ����FeCl3��Һ�����Ի�����dz��ɫ���ֵ�ʱ�䣨2�֣�
��������
�����������1���Ȼ�����ǿ�������Σ�������ˮ����Һ�����ԣ�����ʽΪFe3++ 3H2O Fe(OH)3+ 3H+ ���ڼ��ȵ�������Ũ������ͭ����������ԭ��Ӧ����SO2����Ӧ�Ļ�ѧ����ʽΪCu + 2H2SO4(Ũ)
Fe(OH)3+ 3H+ ���ڼ��ȵ�������Ũ������ͭ����������ԭ��Ӧ����SO2����Ӧ�Ļ�ѧ����ʽΪCu + 2H2SO4(Ũ) CuSO4 + SO2��+2H2O��
CuSO4 + SO2��+2H2O��
��2��SO2����ˮ���������ᣬ�������Ƕ�Ԫ���ᣬ�����������������ӣ�������������ӽ������������Fe(HSO3)2+������Fe(HSO3)2+���ӿ��Խ�Fe3+��ԭΪFe2+���йط�Ӧ�����ӷ���ʽΪH2O+SO2 H2SO3��H2SO3
H2SO3��H2SO3  H++HSO3����Fe3+ + HSO3��
H++HSO3����Fe3+ + HSO3�� Fe(HSO3)2+��Fe3+ + H2O + Fe(HSO3)2+=== 2Fe2+ + SO42�� + 3H+��
Fe(HSO3)2+��Fe3+ + H2O + Fe(HSO3)2+=== 2Fe2+ + SO42�� + 3H+��
��3�����軯����Һ���������ӽ�Ͽ��Բ�����ɫ����������ʵ������Ϊ������ɫ������
��4�����ݲ���ڢ��е�ʵ����������Ʋ�������������Ǽ��ȡ����FeCl3��Һ�����Ի�����dz��ɫ���ֵ�ʱ�䡣
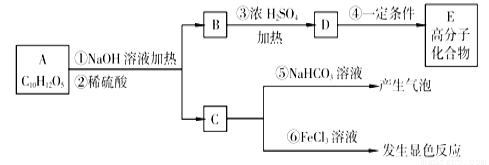
���㣺����ʵ�鷽�������̽��

 ��У����ϵ�д�
��У����ϵ�д���ҵ����CO��H2�ϳ�CH3OH��CO(g)��2H2(g) CH3OH(g)����Ӧ��ƽ�ⳣ�����±���
CH3OH(g)����Ӧ��ƽ�ⳣ�����±���
�¶�/�� | 0 | 100 | 200 | 300 | 400 |
ƽ�ⳣ�� | 667 | 13 | 1.9��10-2 | 2.4��10-4 | 1��10-5 |
����˵����ȷ����
A���÷�Ӧ�ġ�H> 0
B����ѹ������H2Ũ�Ⱥͼ�������������CO��ת����
C����ҵ�ϲ���5 ��103 kPa��250�����������ԭ����ԭ������ת���ʸ�
D��t��ʱ����1 L�ܱ�������Ͷ��0.1 mol CO��0.2 mol H2��ƽ��ʱCOת����Ϊ50%������¶�ʱ��Ӧ��ƽ�ⳣ������ֵΪ100
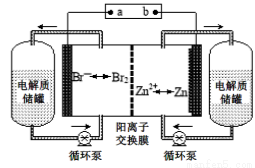
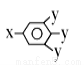 ������-x��-y��Ϊ�����ţ�����ش��������⣺
������-x��-y��Ϊ�����ţ�����ش��������⣺ 2NH3(g)��H<0������Ӧ�ﵽƽ��ʱ�����д�ʩ�����N2ת���ʵ���
2NH3(g)��H<0������Ӧ�ﵽƽ��ʱ�����д�ʩ�����N2ת���ʵ��� ��ԭΪCr3������ͨ�����ڷ�ˮ��pH��ʹ��������ɷ���������������(Fe3O4��Fe2O3��FeO)�ĸ���������
��ԭΪCr3������ͨ�����ڷ�ˮ��pH��ʹ��������ɷ���������������(Fe3O4��Fe2O3��FeO)�ĸ��������� ��������1 mol Cr2O
��������1 mol Cr2O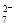 ��ˮ������Ҫ����a mol FeSO4��7H2O�����н�����ȷ����
��ˮ������Ҫ����a mol FeSO4��7H2O�����н�����ȷ����