题目内容
8.氟、氯、溴3种元素同属于周期表中第VIIA族.(1)3种元素中电负性最小的基态原子的价电子排布式是5s25p5.
(2)这三种元素的氢化物的稳定性由强到弱是的次序是(写对应的化学式)HF>HCl>HBr.
(3)氯元素可广泛存在于无机物和有机物中.二氯甲烷(CH2Cl2)是甲烷分子中碳原子上连接的两个氢原子被两个氯原子取代形成的一种氯代物,其分子中碳原子轨道的杂化类型是sp3;氯化铬酰(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应.CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是非极性分子(“极性”或“非极性”).
(4)冰晶石(Na3AlF6)主要用作电解Al2O3生产铝的助熔剂,其晶体不导电,但熔融时能导电.在冰晶石(Na3AlF6)晶体中存在ABC(填选项).
A.离子键 B.极性键 C.配位键 D.范德华力
(5)氰[(CN)2]是一种分子构型和化学性质与卤素单质很相似的化合物,称为拟卤素.一个氰分子中含有4个π键;试写出氰[(CN)2]溶于水的化学方程式(CN)2+H2O=HCN+HCNO.
分析 (1)非金属最弱的为溴,则溴的电负性最小,溴的最外层电子数为7;
(2)元素的非金属性越强,对应氢化物越稳定;
(3)二氯甲烷中,C没有孤对电子,形成4个共价单键;CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,则是由分子构成的物质,由相似相容可知,为非极性分子;
(4)冰晶石(Na3AlF6)晶体中,钠离子与阴离子以离子键结合,Al、F之间既有极性共价键,也有配位键;
(5)氰[(CN)2]的结构简式为N≡C-C≡N,三键中含2个π键,根据氯气与水溶液的反应,类推(CN)2与水的反应.
解答 解:(1)非金属最弱的为溴,则溴的电负性最小,溴的最外层电子数为7,所以溴的基态原子的价电子排布式是5s25p5,故答案为:5s25p5;
(2)同主族自上而下非金属性减弱,所以F、Cl、Br对应的氢化物稳定性由强到弱,即HF>HCl>HBr,故答案为:HF>HCl>HBr;
(3)二氯甲烷中,C没有孤对电子,形成4个共价单键,则C原子的杂化方式为sp3;CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,则是由分子构成的物质,由相似相容可知,为非极性分子,
故答案为:sp3;非极性;
(4)冰晶石(Na3AlF6)晶体中,钠离子与阴离子以离子键结合,Al、F之间既有极性共价键,也有配位键,所以冰晶石(Na3AlF6)晶体中存在离子键、极性键、配位键,
故答案为:ABC;
(5)氰[(CN)2]的结构简式为N≡C-C≡N,三键中含2个π键,所以共有2×2=4个π键,由Cl2+H2O=HCl+HClO可知,(CN)2的化学性质和卤素很相似,则(CN)2与水反应的化学方程式为(CN)2+H2O=HCN+HCNO,
故答案为:4;(CN)2+H2O=HCN+HCNO.
点评 本题以卤族元素考查原子的电子排布、氢键、分子极性及化学键等,侧重原子结构与性质的考查,注意(4)中化学键为解答的难点,综合性较强,题目难度中等.

 阅读快车系列答案
阅读快车系列答案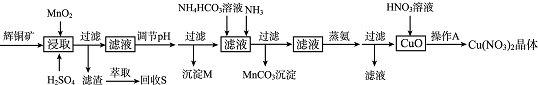
已知:部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
(1)浸取后得到的浸出液中含有CuSO4、MnSO4.写出浸取时产生CuSO4、MnSO4反应的化学方程式2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O.
(2)调节pH的目的是铁离子转化成氢氧化铁完全沉淀,pH的调节范围为3.2≤pH<4.4.
(3)生成MnCO3沉淀的离子方程式为Mn2++NH3+HCO3-=MnCO3↓+NH4+.
(4)操作A为蒸发浓缩、冷却结晶.
(5)由辉铜矿制取铜的反应过程可以表示为:
2Cu2S(s)+3O2 (g)=2Cu2O(s)+2SO2(g)△H=-768.2kJ•mol-l
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)△H=+116.0 kJ•mol-l
则由Cu2S与O2加热反应生成Cu的热化学方程式为Cu2S(s)+02(g)═2Cu(s)+SO2(g)△H=-217.4kJ.mol-l .
(6)若用含85% Cu2S的辉铜矿来制备无水Cu(NO3)2.假设浸取率为95%,调节pH时损失Cu 3%,蒸氨过程中有5%未转化为CuO,其它过程中无损耗,则1.0kg这样的辉铜矿最多能制备1.75kg无水Cu(NO3)2.
| A. | 19:8:13 | B. | 22:1:14 | C. | 13:9:29 | D. | 26:16:27 |
| A. | C6H6 | B. | CH3CHO | C. | CH3COOH | D. | CH2=CH-COOH |
(1)N位于元素周期表第二 周期第ⅤA 族,其基态原子核外有3个未成对电子;S的基态原子核外电子排布式为1s22s22p63s23p4.
(2)用“>”或“<’’填空:
| 第一电离能 | 电负性 | 稳定性 | 酸性 |
| N>O | C<N | H2S<H2O | H2SO4<HClO4 |
(4)NH3可作低温溶剂,它易液化的原因是NH3分子间能形成分子间氢键,氢键的存在使得氨气分子间作用力显著增强,沸点显著升高,易液化.已知25℃、101KPa,NH3能在纯氧中燃烧,每转移1mol e-,放出akJ热量,写出该条件下NH3燃烧的热化学方程式4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-4a kJ/mol.
(5)通常情况下,N2O5为无色晶体,它与Na2O2能发生反应(类似于CO2与Na2O2能反应),写出反应的化学方程式,并用单线桥标出电子转移的方向和数目:
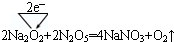 .
. | A. | 酯化 | B. | 氧化 | C. | 加成 | D. | 水解 |
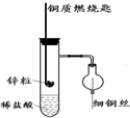 如图是实验室用氢气还原氧化铜实验的简易装置.其中的铜质燃烧匙可以在试管M中上下移动,实验时,先将细铜丝一端被弯成螺旋状,先在空气中加热变黑后再迅速伸入球型干燥管中.
如图是实验室用氢气还原氧化铜实验的简易装置.其中的铜质燃烧匙可以在试管M中上下移动,实验时,先将细铜丝一端被弯成螺旋状,先在空气中加热变黑后再迅速伸入球型干燥管中.