题目内容
某化学兴趣小组用如图装置来完成制取较多量的饱和氯水和制漂白剂等实验.
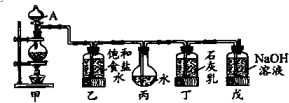
Ⅰ.(1)A仪器的名称: .
(2)证明丙中制得的氯水已饱和的现象是 .
(3)丁中制漂白剂的离子方程式为 .
Ⅱ.某同学探究新制饱和氯水滴到红色布条上,发现红色布条褪色,对产生此现象的原因提出下列假设.
假设1:氯水中Cl2将有色物质氧化褪色
假设2:氯水中 (填化学式)将有色物质氧化褪色
为证明到底是哪种假设正确,该兴趣小组设计了如下实验:
(4)步骤3现象 ;发生反应的离子方程式: .
(5)下列措施可以让新制氯水漂白性增强的是 .(填字母)
A.高温蒸煮B.加AgNO3C.加CaCO3固体D.通入SO2
(6)由上述实验证明假设 成立.有同学认为上述实验不够严谨,于是补充了一个实验:将同样大小的有色布条加入NaHCO3溶液,该同学做此实验的目的是为了 .

Ⅰ.(1)A仪器的名称:
(2)证明丙中制得的氯水已饱和的现象是
(3)丁中制漂白剂的离子方程式为
Ⅱ.某同学探究新制饱和氯水滴到红色布条上,发现红色布条褪色,对产生此现象的原因提出下列假设.
假设1:氯水中Cl2将有色物质氧化褪色
假设2:氯水中
为证明到底是哪种假设正确,该兴趣小组设计了如下实验:
(4)步骤3现象
(5)下列措施可以让新制氯水漂白性增强的是
A.高温蒸煮B.加AgNO3C.加CaCO3固体D.通入SO2
| 实验装置 | 实验现象 |
| 步骤1:将干燥的红布条投入到装有干燥氯气的集气瓶 | 发现有色布条不褪色 |
| 步骤2:将新制的饱和氨水等分成两份分装于A、B两试管 |  |
| 步骤3:向B中加入足量NaHCO3固体 |  |
| 步骤4:同时向A、B两试管加入相同大小的红布条,观察褪色的先后顺序 | B试管褪色所需时间短 |
考点:性质实验方案的设计,氯气的实验室制法,氯、溴、碘的性质实验
专题:实验设计题
分析:Ⅰ.甲为气体发生装置,浓盐酸和二氧化锰在加热条件下反应生成氯气,乙用于除去HCl气体,丙用于吸收氯气,制备饱和氯水,氯气和石灰水反应生成氯化钙、次氯酸钙和水,戊为尾气吸收装置,氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水;
Ⅱ.探究新制饱和氯水滴到红色布条上,发现红色布条褪色,为探究原因设计实验步骤如下:
步骤1:将干燥的红布条投入到装有干燥氯气的集气瓶,发现有色布条不褪色,说明干燥的氯气不具有漂白性;
步骤2:将新制的饱和氨水等分成两份分装于A、B两试管;
步骤3:向B中加入足量NaHCO3固体,因氯水中含有盐酸,可生成二氧化碳气体;
步骤4:同时向A、B两试管加入相同大小的红布条,观察褪色的先后顺序,可说明HClO具有漂白性.
Ⅱ.探究新制饱和氯水滴到红色布条上,发现红色布条褪色,为探究原因设计实验步骤如下:
步骤1:将干燥的红布条投入到装有干燥氯气的集气瓶,发现有色布条不褪色,说明干燥的氯气不具有漂白性;
步骤2:将新制的饱和氨水等分成两份分装于A、B两试管;
步骤3:向B中加入足量NaHCO3固体,因氯水中含有盐酸,可生成二氧化碳气体;
步骤4:同时向A、B两试管加入相同大小的红布条,观察褪色的先后顺序,可说明HClO具有漂白性.
解答:
解:Ⅰ.甲为气体发生装置,浓盐酸和二氧化锰在加热条件下反应生成氯气,乙用于除去HCl气体,丙用于吸收氯气,制备饱和氯水,氯气和石灰水反应生成氯化钙、次氯酸钙和水,戊为尾气吸收装置,氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水
(1)A为分液漏斗,故答案为:分液漏斗;
(2)证明丙中制得的氯水已饱和,可观察到溶液陈黄绿色,且溶液上方有黄绿色气体,故答案为:液体及液体上方均呈黄绿色;
(3)氯气和石灰乳反应生成氯化钙、次氯酸钙和水,反应的离子方程式为Ca(OH)2+Cl2=Ca2++ClO-+Cl-+H2O,故答案为:Ca(OH)2+Cl2=Ca2++ClO-+Cl-+H2O;
Ⅱ.新制饱和氯水滴到红色布条上,发现红色布条褪色,可能原因是氯气具有漂白性,因氯气和水反应生成具有强氧化性的次氯酸,则也可能为次氯酸,
故答案为:HClO;
(4)向B中加入足量NaHCO3固体,因氯水中含有盐酸,可生成二氧化碳气体,促进氯气和水的反应,溶液颜色变浅,发生Cl2+HCO3-=HClO+Cl-+CO2↑,
故答案为:溶液变为无色,且有大量气泡产生;Cl2+HCO3-=HClO+Cl-+CO2↑;
(5)让新制氯水漂白性增强,可增大HClO浓度,但不能消耗HClO,高温促进气体挥发,二氧化硫具有还原性,加入硝酸银溶液和碳酸钙可以,因碳酸钙可盐酸反应,但与次氯酸不反应,加入硝酸银生成AgCl沉淀,使平衡正向移动,
故答案为:BC;
(6)步骤1:将干燥的红布条投入到装有干燥氯气的集气瓶,发现有色布条不褪色,说明干燥的氯气不具有漂白性;
步骤2:将新制的饱和氨水等分成两份分装于A、B两试管;
步骤3:向B中加入足量NaHCO3固体,因氯水中含有盐酸,可生成二氧化碳气体;
步骤4:同时向A、B两试管加入相同大小的红布条,观察褪色的先后顺序,可说明HClO具有漂白性.
由以上实验可知,假设2成立.有同学认为上述实验不够严谨,因步骤3中加入了NaHCO3,补充了一个实验:将同样大小的有色布条加入NaHCO3溶液,该同学做此实验的目的是为了证明NaHCO3不能使有色布条褪色,
故答案为:2;证明NaHCO3不能使有色布条褪色.
(1)A为分液漏斗,故答案为:分液漏斗;
(2)证明丙中制得的氯水已饱和,可观察到溶液陈黄绿色,且溶液上方有黄绿色气体,故答案为:液体及液体上方均呈黄绿色;
(3)氯气和石灰乳反应生成氯化钙、次氯酸钙和水,反应的离子方程式为Ca(OH)2+Cl2=Ca2++ClO-+Cl-+H2O,故答案为:Ca(OH)2+Cl2=Ca2++ClO-+Cl-+H2O;
Ⅱ.新制饱和氯水滴到红色布条上,发现红色布条褪色,可能原因是氯气具有漂白性,因氯气和水反应生成具有强氧化性的次氯酸,则也可能为次氯酸,
故答案为:HClO;
(4)向B中加入足量NaHCO3固体,因氯水中含有盐酸,可生成二氧化碳气体,促进氯气和水的反应,溶液颜色变浅,发生Cl2+HCO3-=HClO+Cl-+CO2↑,
故答案为:溶液变为无色,且有大量气泡产生;Cl2+HCO3-=HClO+Cl-+CO2↑;
(5)让新制氯水漂白性增强,可增大HClO浓度,但不能消耗HClO,高温促进气体挥发,二氧化硫具有还原性,加入硝酸银溶液和碳酸钙可以,因碳酸钙可盐酸反应,但与次氯酸不反应,加入硝酸银生成AgCl沉淀,使平衡正向移动,
故答案为:BC;
(6)步骤1:将干燥的红布条投入到装有干燥氯气的集气瓶,发现有色布条不褪色,说明干燥的氯气不具有漂白性;
步骤2:将新制的饱和氨水等分成两份分装于A、B两试管;
步骤3:向B中加入足量NaHCO3固体,因氯水中含有盐酸,可生成二氧化碳气体;
步骤4:同时向A、B两试管加入相同大小的红布条,观察褪色的先后顺序,可说明HClO具有漂白性.
由以上实验可知,假设2成立.有同学认为上述实验不够严谨,因步骤3中加入了NaHCO3,补充了一个实验:将同样大小的有色布条加入NaHCO3溶液,该同学做此实验的目的是为了证明NaHCO3不能使有色布条褪色,
故答案为:2;证明NaHCO3不能使有色布条褪色.
点评:本题综合考查氯气的性质实验设计,为高考常见题型,侧重于学生的分析能力和实验能力的考查,主要把握实验的原理和步骤,结合物质的性质解答该题,难度中等.

练习册系列答案
相关题目
将等物质的量的X、Y气体充入一个密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g)?2Z(g);△H<0.当改变某个条件并维持新条件直至达到新平衡,下列说法正确的是( )
| A、充入一定量Z,X的体积分数增大 |
| B、增大压强,Z的浓度不变 |
| C、减小压强,Y的体积分数变大 |
| D、充入一定量X,平衡正向移动,X的体积分数增大 |
乙醇可以发生下列反应,在反应中乙醇分子断裂C-O键而失去羟基的是( )
| A、乙醇在浓硫酸存在下发生消去反应 |
| B、乙醇与金属钠反应 |
| C、乙醇的酯化反应 |
| D、乙醇在铜丝存在条件下发生催化氧化 |
用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的是( )
A、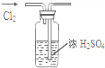 干燥Cl2 干燥Cl2 |
B、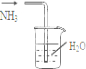 吸收NH3 |
C、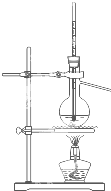 制取蒸馏水 |
D、 吸收SO2 吸收SO2 |
紫罗兰α鸢尾酮香料的分子结构如图所示,下列说法中不正确的是( )
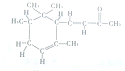

| A、α-鸢尾酮可与某种酚互为同分异构体 |
| B、1mol α-鸢尾酮最多可与2mol H2加成 |
| C、α-鸢尾酮能发生银镜反应 |
D、α-鸢尾酮经加氢→消去反应可转变为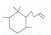 |
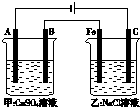 如图为相互串联的甲、乙两个电解池(电极都是惰性电极),请回答:
如图为相互串联的甲、乙两个电解池(电极都是惰性电极),请回答:
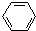 +CH2=CH2
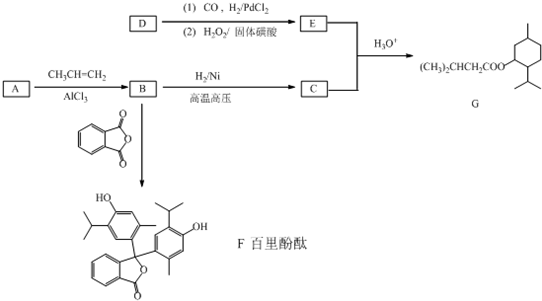
+CH2=CH2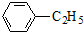 G(异戊酸薄荷醇酯)是一种治疗心脏病的药物,可由A(分子式为C7H8O,能与FeCl3溶液发生显色反应)和烯烃D(分子式C4H8)等为原料制取,合成路线如下:
G(异戊酸薄荷醇酯)是一种治疗心脏病的药物,可由A(分子式为C7H8O,能与FeCl3溶液发生显色反应)和烯烃D(分子式C4H8)等为原料制取,合成路线如下: