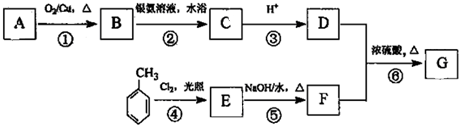
题目内容
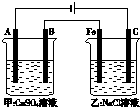 如图为相互串联的甲、乙两个电解池(电极都是惰性电极),请回答:
如图为相互串联的甲、乙两个电解池(电极都是惰性电极),请回答:(1)写出两电解池中的电解反应方程式:甲
(2)若甲槽阴极增重25.6g,则乙槽阳极放出气体在标准状况下的体积为
(3)若乙槽剩余液体为400mL,则电解后得到碱液的物质的量浓度为
考点:电解原理
专题:
分析:(1)甲电解池中,阳极上氢氧根离子放电生成氧气,阴极上铜离子放电生成铜,据此写出电池反应式;
(2)甲槽阴极增重25.6g,则根据阴极电极反应和电子守恒计算乙池阳极碳电极上生成气体体积;
(3)根据氯气和氢氧化钠的关系式计算氢氧化钠的物质的量浓度.
(2)甲槽阴极增重25.6g,则根据阴极电极反应和电子守恒计算乙池阳极碳电极上生成气体体积;
(3)根据氯气和氢氧化钠的关系式计算氢氧化钠的物质的量浓度.
解答:
解:(1)甲装置中,电极都是惰性电极,所以电解硫酸铜溶液时,阳极上氢氧根离子放电生成氧气,阴极上铜离子放电生成铜,所以电池反应式为:2CuSO4+2H2O
2Cu+O2↑+2H2SO4,故答案为:2CuSO4+2H2O
2Cu+O2↑+2H2SO4;
(2)当甲槽阴极增重25.6g时,阴极上铜离子放电生成铜,则铜的物质的量=
=0.4mol,电极反应Cu2++2e-=Cu,电子转移0.8mol,乙槽中,阳极C上氯离子放电,电极反应为:2Cl--2e-=Cl2↑,产生的气体在标准状况下的体积0.4mol,体积=0.4mol×22.4L/mol=8.96L,
故答案为:8.96L;
(3)乙池中电池反应式为2NaCl+2H2O
H2↑+Cl2↑+2NaOH,根据氯气和氢氧化钠的关系式知,生成0.4mol氯气时同时生成0.8mol氢氧化钠,
则氢氧化钠的物质的量浓度=
=2mol/L,故答案为:2mol/L.
| ||
| ||
(2)当甲槽阴极增重25.6g时,阴极上铜离子放电生成铜,则铜的物质的量=
| 25.6 |
| 64 |
故答案为:8.96L;
(3)乙池中电池反应式为2NaCl+2H2O
| ||
则氢氧化钠的物质的量浓度=
| 0.8mol/L |
| 0.4L |
点评:本题考查电解原理及利用电子守恒的计算,明确阴阳极的判断及发生的电极反应是解答本题的关键,难度中等.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
某胶体遇盐卤(MgCl2 )或石膏水发生凝聚,而遇食盐水或Na2SO4 溶液不易发生凝聚,下列说法中错误的是( )
| A、胶体粒子直径在lnm~100nm |
| B、遇BaCl2溶液或Fe(OH)3胶体可发生聚沉 |
| C、电泳时,该胶体向阴极方向移动 |
| D、Na+使此胶体凝聚的效果不如Ca2+、Mg2+ |
能正确表示下列反应的离子方程式的是( )
| A、浓盐酸和铁屑反应:2Fe+6H+═2Fe3++3H2 ↑ |
| B、碳酸钙与醋酸的反应:CaCO3+2H+═Ca2++CO2↑+H2O |
| C、用澄清的石灰水吸收过量的CO2:CO2+OH-═HCO3- |
| D、向NaHSO4溶液中加入Ba(OH)2 使SO42-恰好完全沉淀:Ba2++2OH-+2H++SO42-═BaSO4 ↓+2H2O |
可以证明酒精中含有水的物质是( )
| A、生石灰 | B、浓硫酸 |
| C、无水硫酸铜 | D、金属钠 |