题目内容
向含有0.2mol NaOH和0.1mol Ba(OH)2的溶液中持续稳定地通入CO2,当通入气体为8.96L(标况下)时立即停止,则这一过程中,溶液中离子的物质的量与通入CO2的体积关系图象正确的是(气体的溶解和离子的水解忽略不计)( )
A、 |
B、 |
C、 |
D、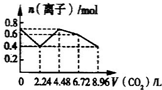 |
考点:化学方程式的有关计算,离子方程式的有关计算
专题:计算题
分析:n(CO2)=
=0.4mol,通入含有0.2molNaOH和0.1molBa(OH)2的溶液中,相当于首先发生:Ba2++2OH-+CO2=BaCO3↓+H2O,0.1molBa(OH)2完全反应消耗0.1molCO2,剩余0.2molOH-,生成0.1molBaCO3,然后发生2OH-+CO2=CO32-+H2O,消耗0.1molCO2,生成0.1molCO32-,上述两阶段共消耗0.2molCO2,剩余0.2molCO2,再发生CO32-+CO2+H2O=2HCO3-,消耗0.1molCO2,最后发生BaCO3+CO2+H2O=Ba2++2HCO3-,碳酸钡与二氧化碳恰好反应,据此计算解答.
| 8.96L |
| 22.4L/mol |
解答:
解:含有0.2mol NaOH和0.1mol Ba(OH)2的溶液中离子总的物质的量为0.2mol×2+0.1mol×3=0.7mol,
n(CO2)=
=0.4mol,
通入含有0.2molNaOH和0.1molBa(OH)2的溶液中,相当于首先发生:Ba2++2OH-+CO2=BaCO3↓+H2O,该阶段0.1molBa(OH)2完全反应消耗0.1molCO2,体积为2.24L,离子物质的量减少0.3mol,溶液中离子物质的量为0.7mol-0.3mol=0.4mol,其中含有0.2molOH-、生成0.1molBaCO3;
然后发生2OH-+CO2=CO32-+H2O,0.2molOH-完全反应消耗0.1molCO2,体积为2.24L,该阶段离子物质的量减少0.1mol,溶液中剩余离子物质的量为0.4mol-0.1mol=0.3mol,溶液中含有0.2molNa+、0.1molCO32-;
再发生CO32-+CO2+H2O=2HCO3-,消耗0.1molCO2,体积为2.24L,溶液中离子物质的量增大0.1mol,溶液中离子为0.4mol;
最后发生BaCO3+CO2+H2O=Ba2++2HCO3-,碳酸钡与二氧化碳恰好反应,消耗0.1molCO2,体积为2.24L,溶液中离子物质的量增大0.3mol,溶液中中离子为0.7mol;
故图象C符合,故选C.
n(CO2)=
| 8.96L |
| 22.4L/mol |
通入含有0.2molNaOH和0.1molBa(OH)2的溶液中,相当于首先发生:Ba2++2OH-+CO2=BaCO3↓+H2O,该阶段0.1molBa(OH)2完全反应消耗0.1molCO2,体积为2.24L,离子物质的量减少0.3mol,溶液中离子物质的量为0.7mol-0.3mol=0.4mol,其中含有0.2molOH-、生成0.1molBaCO3;
然后发生2OH-+CO2=CO32-+H2O,0.2molOH-完全反应消耗0.1molCO2,体积为2.24L,该阶段离子物质的量减少0.1mol,溶液中剩余离子物质的量为0.4mol-0.1mol=0.3mol,溶液中含有0.2molNa+、0.1molCO32-;
再发生CO32-+CO2+H2O=2HCO3-,消耗0.1molCO2,体积为2.24L,溶液中离子物质的量增大0.1mol,溶液中离子为0.4mol;
最后发生BaCO3+CO2+H2O=Ba2++2HCO3-,碳酸钡与二氧化碳恰好反应,消耗0.1molCO2,体积为2.24L,溶液中离子物质的量增大0.3mol,溶液中中离子为0.7mol;
故图象C符合,故选C.
点评:本题考查离子方程式的计算,难度较大,清楚各阶段发生的反应是关键,注意B和C的区别,为易错点.

练习册系列答案
相关题目
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
| 物质 编号 |
物质转化关系 | 甲 | 乙 | 丙 | 丁 |
| ① |  |
Cu | CuO | CuSO4 | Cu(NO3)2 |
| ② | Na2CO3 | NaOH | NaHCO3 | CO2 | |
| ③ | (NH4)2SO3 | CaSO3 | SO2 | NH4HSO3 | |
| ④ | CH3CH2Cl | C2H5OH | CH2=CH2 | CH3CH3 |
| A、①②③④ | B、①②③ |
| C、①③④ | D、②④ |
 下表中所示概念问的从属关系不符合如图所示的是( )
下表中所示概念问的从属关系不符合如图所示的是( )| 选项 | X | Y | Z |
| A | 氧化物 | 化合物 | 纯净物 |
| B | 胶体 | 分散系 | 混合物 |
| C | 卤代烃 | 烃 | 有机物 |
| D | 离子化合物 | 电解质 | 化合物 |
| A、A | B、B | C、C | D、D |
根据表中信息,判断下列叙述中正确的是( )
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | / | Fe3+、Br2 | |
| ② | KClO3 | 浓盐酸 | / | Cl2 | |
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
| A、由表中①组的信息可知通入Cl2的量不同,氧化产物可能不同 | |||||||||||
| B、氧化性强弱的比较:KClO3>Fe3+>Cl2>Br2 | |||||||||||
| C、表中②组反应的还原产物是KCl,转移6e- | |||||||||||
D、表中③组反应的离子方程式为2Mn
|
下列说法不正确的是( )
①将BaSO4放入水中不能导电,所以BaSO4是非电解质
②氨溶于水得到的氨水能导电,所以氨水是电解质
③固态共价化合物不导电,熔融态的共价化合物可以导电
④固态的离子化合物不导电,熔融态的离子化合物也不导电
⑤强电解质溶液的导电能力一定比弱电解质溶液的导电能力强.
①将BaSO4放入水中不能导电,所以BaSO4是非电解质
②氨溶于水得到的氨水能导电,所以氨水是电解质
③固态共价化合物不导电,熔融态的共价化合物可以导电
④固态的离子化合物不导电,熔融态的离子化合物也不导电
⑤强电解质溶液的导电能力一定比弱电解质溶液的导电能力强.
| A、①④ | B、①④⑤ |
| C、①②③④ | D、①②③④⑤ |
下表是几种常见弱酸的电离方程式及电离平衡常数(25℃).
下列说法正确的是( )
| 酸 | 电离方程式 | 电离平衡常数K | ||||||||||
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 | ||||||||||
| H2CO3 | H2CO3?H++HCO
HCO
|
K1=4.31×10-7 K2=5.61×10-11 | ||||||||||
| H3PO4 | H3PO4?H++H2PO
H2PO
HPO
|
K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
| A、温度升高,K减小 | ||||||
B、向0.1 mol/L CH3COOH溶液中加入少量冰醋酸,
| ||||||
| C、等物质的量浓度的各溶液pH关系为pH(Na2CO3)>pH(CH3COONa)>pH(Na3PO4) | ||||||
D、P
|
某活动小组为探究金属腐蚀的相关原理,设计了如图a所示的装置,图a的铁棒末端分别连上一块Zn片和Cu片,并置于含有K3Fe(CN)6及酚酞的混合凝胶上.一段时间后发现凝胶的某些区域(如图b所示)发生了变化.已知Fe2+可用K3Fe(CN)6来检验(呈蓝色).则下列说法不正确的是( )


| A、甲区发生的电极反应式为Fe-2e═Fe2+ |
| B、乙区产生Zn2+ |
| C、丙区呈红色 |
| D、丁区呈蓝色 |
