题目内容
1.电化学原理在金属腐蚀、能量转换环境保护等方面应用广泛.
(1)通常可用图1、图2所示的两种方式减缓海水埘钢闸门A的腐蚀,则图1中防止腐蚀的方法名称是牺牲阳极的阴极保护法;图2中材料C最好选择d.(填字母序号)
a.钠块b.铜块c.锌块d.石墨
(2)己知:铬能与稀硫酸反应,生成氢气和硫酸亚铬(CrSO4).
①铜铬构成原电池如图3所示,其中盛稀硫酸烧杯中的现象为铜电极上有气泡产生.
盐桥中装的是饱和KC1琼脂溶液,下列关于此电池的说法正确的是B.
A.盐桥的作用是使整个装置构成通路、保持溶液呈电中性,凡是有盐桥的原电池,盐桥中均可以用饱和KC1琼脂溶液
B.理论上1mol Cr溶解,盐桥中将有2mol Cl-进入左池,2molK+进入右池
C.此过程中H+得电子,发生氧化反应
D.电子从铬极通过导线到铜极,又通过盐桥转移到左烧杯中
②如构成图4电池发现,铜电极上不再有图1的现象,铬电极上产生大量气泡,遇空气呈红棕色.写出正极电极反应式4H++NO3-+3e-=NO↑+2H2O.
(3)工业上,采用石墨、铁棒作为电极,电解除去废水中的CN-(C为+4价.下同),装置如图所示,通电过程中,阴、阳两极均有无色无味的气体产生,阳极区两种离子的放电产物会进一步发生反应,其方程式为3C12+2CNO-+80H-═N2+6Cl-+2CO32-+4H2O.
①铁电极应连接直流电源的负极.(填写电极名称)
②阴极产物 有氢气,阳极上发生的电极反应为:2Cl-2e-=Cl2和CN--2e-+2OH-═CNO-+H2O.

分析 (1)形成原电池时,Fe作正极被保护;电解池中Fe作阴极被保护;C为阳极,阳极接石墨,不需要频繁更换;
(2)①Cr比铜活泼,Cr为负极,Cu为正极,正极上氢离子得电子;
A、盐桥中不是都可以用饱和KCl琼脂溶液,要考虑能否与电解质溶液反应;
B、1molCr反应,转移2mol电子;
C、氢离子得电子发生还原反应;
D、盐桥中是离子移动,无电子通过;
②正极上是硝酸根离子得电子生成NO,结合电荷守恒和原子守恒书写电极反应式;
(3)根据发生的电极反应,可以知道金属铁是阴极,石墨电极是阳极,根据电解质中离子的放电顺序以及电极反应和电子的转移知识来回答即可.
解答 解:(1)原电池原理保护金属铁时,将铁与比铁活泼的金属相连,属于牺牲阳极的阴极保护法;电解池原理保护金属铁时,铁作阴极,阳极接石墨,不需要频繁更换;
故答案为:牺牲阳极的阴极保护法;d;
(2)①Cr比铜活泼,Cr为负极,Cu为正极,正极上氢离子得电子,所以铜电极上有气泡生成;
A、盐桥中不是都可以用饱和KCl琼脂溶液,若电解质溶液为硝酸银溶液时,会生成沉淀,故A错误;
B、1molCr反应,转移2mol电子,为保持电荷守恒,盐桥中将有2molCl-进入左池,2molK+进入右池,故B正确;
C、氢离子得电子发生还原反应,故C错误;
D、盐桥中是离子移动,无电子通过,故D错误;
故答案为:铜电极上有气泡产生;B;
②正极上是硝酸根离子得电子生成NO,有氢离子参与反应,电极反应式为:4H++NO3-+3e-=NO↑+2H2O,
故答案为:4H++NO3-+3e-=NO↑+2H2O;
(3)①根据发生的电极反应,可以知道金属铁是阴极,接电源的负极,故答案为:负极;
②阴极上氢离子放电发生还原反应,生成氢气,阳极发生氧化反应,阳极的电极反应式为:CN--2e-+2OH-═CNO-+H2O和2Cl--2e-═Cl2↑,
故答案为:CN--2e-+2OH-═CNO-+H2O.
点评 本题考查了原电池原理和电解池原理的分析应用,把握原电池原理和电解池原理以及电解过程中电子的移动方向,掌握基础是关键,题目难度中等,侧重于考查学生的分析能力.

| A. | ①② | B. | ③⑤ | C. | ①③④ | D. | ③⑤⑥ |
| A. | 28g乙烯中的电子总数为12NA | |
| B. | 1L0.1mol•L-1NH4Cl溶液中含有的氮原子数小于0.1NA | |
| C. | 5.85g氯化钠晶体中含有Na+数为0.1NA | |
| D. | 氢气和氯气反应生成标准状况下22.4L氯化氢,断裂化学键的总数为2NA |
| A. | C(s)+O2(g)→CO2(g)+393kJ | B. | C+O2→CO2+393kJ | ||
| C. | C(s)+O2(g)→CO2(g)-393kJ | D. | C(s)+1/2O2(g)→CO(g)+393kJ |
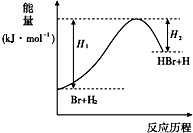
| A. | 正反应为放热反应 | |
| B. | 反应物总能量高于生成物总能量 | |
| C. | 升高温度可增大正反应速率,降低逆反应速率 | |
| D. | 加入催化剂,该化学反应的反应物的总能量与生成物的总能量差不改变 |
| A. | F-的结构示意图: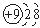 | B. | O-18的原子符号:${\;}_{10}^{18}$O | ||
| C. | NaCl的电子式: | D. | N2的结构式::N≡N: |