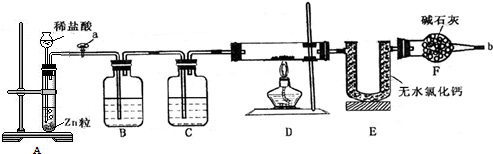
题目内容
9.(1)25℃时,部分物质的电离平衡常数如表所示:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(2)体积为10mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH变化如图1:则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的平衡常数.
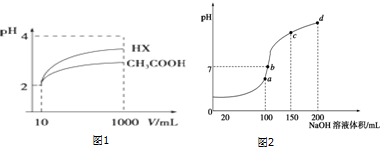
(3)H+浓度相同等体积的两份溶液A(盐酸)和B(CH3COOH)分别与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是③④⑤ (填写序号).
①反应所需要的时间B>A ②开始反应时的速率A>B
③参加反应的锌的物质的量A=B ④反应过程的平均速率B>A
⑤A 中有锌剩余 ⑥B中有锌剩余
(4)室温时,向100mL 0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图2所示:试分析图中a、b、c、d四个点,水的电离程度最大的是a;在b点,溶液
中各离子浓度由大到小的排列顺序是c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).
分析 (1)电离平衡常数越大,酸的电离程度越大,溶液酸性越强;
(2)由图可知,稀释相同的倍数,HX的pH变化程度大,则酸性HX强,电离平衡常数大;
(3)氢离子浓度相同的等体积的A、B两份溶液(A为盐酸,B为醋酸)分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,由于醋酸部分电离,其酸的浓度大于氢离子浓度,盐酸中HCl的浓度等于氢离子的浓度,所以醋酸的浓度大于HCl的浓度,则盐酸中锌粉剩余,以此解答该题;
(4)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3•H2O,(NH4)2SO4可以促进水的电离,而NH3•H2O抑制水的电离.b点溶液呈中性.
解答 解:(1)根据表中数据可知,酸的电离出平衡常数大小为:CH3COOH>H2CO3>HCO3->HClO,电离平衡常数越大,酸性越强,所以酸性由强到弱的顺序为为:CH3COOH>H2CO3>HClO,
故答案为:CH3COOH>H2CO3>HClO;
(2)根据图象分析知道,起始是两种溶液中c(H+)相同,c(较弱酸)>c(较强酸),稀释过程中较弱酸的电离程度增大,故在整个稀释过程中较弱酸的c(H+)一直大于较强酸的c(H+),稀释相同倍数,HX的pH变化比CH3COOH的大,故HX酸性强,电离平衡常数大,
故答案为:大于;
(3)氢离子浓度相同的等体积的A、B两份溶液(A为盐酸,B为醋酸)分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,由于醋酸部分电离,其酸的浓度大于氢离子浓度,盐酸中HCl的浓度等于氢离子的浓度,所以醋酸的浓度大于HCl的浓度,则盐酸中锌粉剩余;
①由于醋酸中酸过量,则反应较快,所以反应所需的时间A>B;故错误;
②开始pH相同,则氢离子浓度相同,所以开始时反应速率A=B,故错误;
③由于生成的氢气体积相同,所以参加反应的锌粉物质的量A=B,故正确;
④醋酸的浓度大于盐酸的浓度,则醋酸中反应速率大,所以反应过程中的平均速率 B>A,故正确;
⑤醋酸的浓度大于盐酸的浓度,醋酸有剩余,则盐酸中有锌粉剩余,故正确;
⑥醋酸的浓度大于盐酸的浓度,醋酸有剩余,则盐酸中有锌粉剩余,故错误;
故选:③④⑤;
(4)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3•H2O,(NH4)2SO4可以促进水的电离,而NH3•H2O抑制水的电离.b点溶液呈中性,即溶液含有(NH4)2SO4、Na2SO4、NH3•H2O三种成分,a点时c(Na+)=c(SO42-),b点时c(Na+)>c(SO42-),根据N元素与S元素的关系,可以得出c(SO42-)>c(NH4+),故c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),
故答案为:a;c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).
点评 本题考查了弱电解质的电离及其影响和离子浓度大小的比较,题目难度中等,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用所学知识的能力.

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案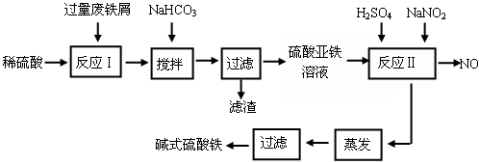
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)加入少量NaHCO3的目的是调节pH在4.4-7.5范围内,使溶液中的杂质离子沉淀.该工艺中“搅拌”的作用是增大接触面积、加快反应速率.
(2)反应Ⅱ中加入NaNO2的目的是氧化Fe2+,发生反应的离子方程式为2H++Fe2++NO2-=Fe3++NO↑+H2O
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,Fe(OH)2+可部分水解生成Fe2(OH)42+聚合离子,该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为D
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液.
| A. | 气体的分子大小不同 | B. | 气体的物质的量不同 | ||
| C. | 气体的性质不同 | D. | 气体的分子间距离不同 |
| A. | 消耗盐酸一样多 | B. | 放出CO2一样多 | ||
| C. | 消耗盐酸后者多 | D. | 后者放出CO2的量是前者的一半 |
| A. | 常用明矾或硫酸铝做净水剂 | |
| B. | 实验室将氯化铁晶体溶于浓盐酸来配制饱和氯化铁溶液 | |
| C. | 用热的纯碱液清洗餐具表面的油污比用冷的溶液效果好 | |
| D. | 泡沫灭火器中用NaHCO3溶液和Al2(SO4)3溶液发生反应产生CO2 |
| A. | $\frac{1000aρ}{(50a+m)}$ mol/L | B. | $\frac{aρ}{(46a+m)}$ mol/L | ||
| C. | $\frac{1000aρ}{(46a+m)}$ mol/L | D. | $\frac{1000aρ}{(47a+m)}$ mol/L |

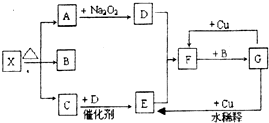 图的各方框表示有关的一种反应物或生成物(某些物质已经略去),X分解所得A、B、C混合气体的平均相对分子质量为24,其中常温下A、C、D为无色气体,B为无色液体,C能使湿润的红色石蕊试纸变蓝.
图的各方框表示有关的一种反应物或生成物(某些物质已经略去),X分解所得A、B、C混合气体的平均相对分子质量为24,其中常温下A、C、D为无色气体,B为无色液体,C能使湿润的红色石蕊试纸变蓝.