题目内容
12.对于反应2Na2O2+2CO2═2Na2CO3+O2,下列说法正确的是( )| A. | Na2O2是氧化剂,CO2是还原剂 | |
| B. | 若2molNa2O2完全反应,则反应中共转移了4mol电子 | |
| C. | 还原剂与氧化剂的质量比是1:1 | |
| D. | Na2O2中阳离子与阴离子的个数比为1:1 |
分析 该反应中,O元素化合价由-价变为-2价和0价,所以过氧化钠既是氧化剂又是还原剂,以此来解答.
解答 解:A.该反应中CO2中各元素化合价不变,所以二氧化碳既不是氧化剂又不是还原剂,过氧化钠既是氧化剂又是还原剂,故A错误;
B.若有2 mol Na2O2参加反应,则转移电子的物质的量为2mol×(1-0)=2 mol,则每摩尔Na2O2完全反应时转移电子1mol,故B错误;
C.过氧化钠既是氧化剂又是还原剂,还原剂与氧化剂的质量比是1:1,故C正确;
D.Na2O2中阳离子是钠离子与阴离子是过氧根离子,两者的个数比为2:1,故D错误;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
3.下列说法不正确的是( )
| A. | 光导纤维的主要成分是 SiO2 | |
| B. | 石英玻璃常用来制耐高温的化学仪器 | |
| C. | 硅酸盐工业使用的每一种原料中都含有硅 | |
| D. | 水泥和普通玻璃都是混合物 |
7.下列物质中,属于强电解质的是( )
| A. | 铜 | B. | Na2SO4 | C. | CH3COOH | D. | NaCl 溶液 |
4.碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
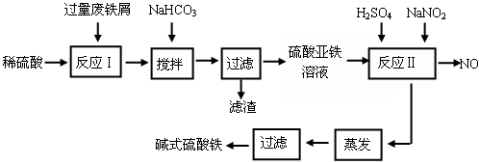
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH在4.4-7.5范围内,使溶液中的杂质离子沉淀.该工艺中“搅拌”的作用是增大接触面积、加快反应速率.
(2)反应Ⅱ中加入NaNO2的目的是氧化Fe2+,发生反应的离子方程式为2H++Fe2++NO2-=Fe3++NO↑+H2O
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,Fe(OH)2+可部分水解生成Fe2(OH)42+聚合离子,该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为D
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液.

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)加入少量NaHCO3的目的是调节pH在4.4-7.5范围内,使溶液中的杂质离子沉淀.该工艺中“搅拌”的作用是增大接触面积、加快反应速率.
(2)反应Ⅱ中加入NaNO2的目的是氧化Fe2+,发生反应的离子方程式为2H++Fe2++NO2-=Fe3++NO↑+H2O
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,Fe(OH)2+可部分水解生成Fe2(OH)42+聚合离子,该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为D
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液.
1.相同物质的量的Na2CO3和NaHCO3固体都经过充分加热后的固体分别跟足量的盐酸反应.下列判断正确的是( )
| A. | 消耗盐酸一样多 | B. | 放出CO2一样多 | ||
| C. | 消耗盐酸后者多 | D. | 后者放出CO2的量是前者的一半 |
 某温度下,水的离子积Kw=l×10-11.有pH=a的酸溶液A,pH=b的碱溶液B.某同学利用如图所示的实验装置,进行实验.
某温度下,水的离子积Kw=l×10-11.有pH=a的酸溶液A,pH=b的碱溶液B.某同学利用如图所示的实验装置,进行实验.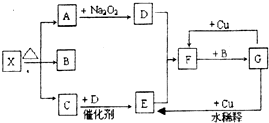 图的各方框表示有关的一种反应物或生成物(某些物质已经略去),X分解所得A、B、C混合气体的平均相对分子质量为24,其中常温下A、C、D为无色气体,B为无色液体,C能使湿润的红色石蕊试纸变蓝.
图的各方框表示有关的一种反应物或生成物(某些物质已经略去),X分解所得A、B、C混合气体的平均相对分子质量为24,其中常温下A、C、D为无色气体,B为无色液体,C能使湿润的红色石蕊试纸变蓝.
 .
.