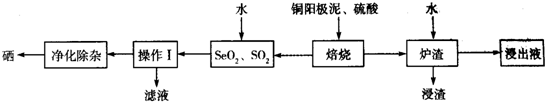
题目内容
3.据统计,机动车保有量每年以15%至20%的速度增长,交通事故也频发;汽车在剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3═K2O+5Na2O+16N2↑.则下列判断正确的是( )| A. | 还原剂与氧化产物的物质的量之比为5:8 | |
| B. | 若氧化产物比还原产物多1.4mol则转移电子为1mol | |
| C. | 每生成1.6mol氮气,则有0.2molKNO3被氧化 | |
| D. | NaN3属于硝酸盐 |
分析 10NaN3+2KNO3═K2O+5Na2O+16N2↑中,N元素的化合价由负价升高为0,N元素的化合价由+5价降低为0,该反应中转移2×(5-0)=10e-,以此来解答.
解答 解:A.10NaN3中N元素的化合价由负价升高为0为还原剂生成15N2为氧化产物,则还原剂与氧化产物的物质的量之比为2:3,故A错误;
B.由反应可知,转移10mol电子时氧化产物比还原产物多14mol,则若氧化产物比还原产物多1.4mol则转移电子为1mol,故B正确;
C.每生成1.6mol氮气,转移1mol电子,则有0.2molKNO3被还原,故C错误;
D.NaN3是氮化物,不属于硝酸盐,故D错误;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,注意从化合价角度分析,将N3-作为-整体来分析为解答的难点,题目难度中等.

练习册系列答案
相关题目
13.下列反应的离子方程式书写正确的是( )
| A. | 氯化铜溶液与铁粉反应:Cu2++Fe═Fe2++Cu | |
| B. | 稀H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀H2SO4反应:Ba2++SO42-═BaSO4↓ | |
| D. | 三氯化铁溶液跟过量氨水反应Fe3++3OH-═Fe(OH)3↓ |
18.下列反应达到平衡后,保持温度和容器体积不变,再加入一定量的反应物.再次达到平衡后反应物的转化率会增大的是( )
| A. | 2NO2(g)?N2O4(g) | B. | 2HI(g)?H2(g)+I2(g) | ||
| C. | PCl5?PCl3(g)+Cl2(g) | D. | CaCO3(s)?CaO(g)+CO2 (g) |
8.从2L1mol/L NaOH溶液中取出100mL,下列关于这100mL溶液的叙述错误的是( )
| A. | 浓度为0.1mol/L | B. | 浓度为1mol/L | C. | 含NaOH 4g | D. | 含NaOH 0.1mol |
 .
.