题目内容
10.硒(Se)及其化合物在工农业生产中有许多用途.以铜阳极泥(主要成分为Ag2Se、Cu2Se和银、金、铂等)为原料制备纯硒的工艺流程如图所示: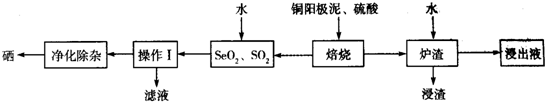
已知:Ksp(Ag2SO4)=1.4×10-5.
回答下列问题:
(1)“焙烧”时所加的硫酸浓度最好为d.
a.10% b.50% c.70% d.98%
(2)加硫酸焙烧过程中Cu2Se参与反应的化学方程式为Cu2Se+6H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+SeO2↑+4SO2↑+6H2O,该反应的还原剂是Cu2Se.
(3)“炉渣”加水浸出的过程中炉渣需粉碎,且加入温水进行浸泡,目的是加快浸出速率,“浸渣”中含有的金属成分是Au、Pt,若“浸出液”中c(Ag+)=3.0×10-2mol•L-1,则溶液中c(SO42-)最大为1.6×10-2moL/L(保留两位有效数字).
(4)操作Ⅰ的名称为过滤.
(5)+4价Se的氧化性强于+4价S的氧化性,SeO2、SO2混合气体用水吸收所发生反应的化学方程式为SeO2+2SO2+2H2O=2H2SO4+Se↓.
(6)操作Ⅰ所得粗硒中含有Ni、Fe、Cu等杂质,可采用真空蒸馏的方法进行提纯,获得纯硒.真空蒸馏的挥发物中硒含量与温度的关系如图所示:

蒸馏操作中控制的最佳温度是C.
a.455℃b.462℃c.475℃d.515℃
分析 以铜阳极泥(主要成分为Ag2Se、Cu2Se和银、金、铂等)加入硫酸焙烧,得到SeO2、SO2,浓硫酸起氧化剂作用,由元素守恒可知还生成CuSO4与水,Ag也能与浓硫酸反应生成Ag2SO4,滤渣再进行水浸,浸出液中含有CuSO4、Ag2SO4,浸渣中含有Au、Pt.+4价Se的氧化性强于+4价S的氧化性,SeO2、SO2混合气体用水吸收得到H2SO4、Se,过滤分离,滤液中含有硫酸,经过净化除杂得到Se.
(1)“加硫酸并焙烧”时的硫酸起氧化剂作用,用选用浓硫酸;
(2)“加硫酸并焙烧”过程中Cu2Se与浓硫酸反应生成CuSO4、SeO2、SO2与水,Cu2Se是还原剂;
(3)增大接触面积、提供温度可以加快浸出速率,“浸渣”中含有与浓硫酸不反应的Au、Pt,根据Ksp(Ag2S04)=c2(Ag+)×c(SO42-)=1.4×10-5计算“浸出液”中c(SO42-);
(4)操作I是分离互不相溶的固体与液体;
(5)4价Se的氧化性强于+4价S的氧化性,SeO2、SO2混合气体用水吸收得到H2SO4、Se;
(6)选择真空蒸馏的挥发物中硒含量最大时的温度.
解答 解:(1)“加硫酸并焙烧”时S元素化合价降低,硫酸起氧化剂作用,用选用98%的浓硫酸,
故答案为:d;
(2)“加硫酸并焙烧”过程中Cu2Se与浓硫酸反应生成CuSO4、SeO2、SO2与水,反应方程式为:Cu2Se+6H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+SeO2↑+4SO2↑+6H2O,反应中Cu、Se元素化合价升高,故Cu2Se是还原剂,
故答案为:Cu2Se+6H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+SeO2↑+4SO2↑+6H2O;Cu2Se;
(3))“炉渣加水浸出”中的炉渣需粉碎,且加入温水进行浸泡,目的是加快浸出速率,““浸渣”中含有与浓硫酸不反应的Au、Pt,滤液中c(Ag+)=3.0×10-2mol/L,根据Ksp(Ag2S04)=c2(Ag+)×c(SO42-)=1.4×10-5,可知“浸出液”中c(SO42-)=$\frac{1.4×1{0}^{-5}}{(3.0×1{0}^{-2})^{2}}$mol/L=1.6×10-2moL/L,
故答案为:加快浸出速率;Au、Pt;1.6×10-2moL/L;
(4)操作I是分离互不相溶的固体与液体,应采取过滤分离,
故答案为:过滤;
(5)4价Se的氧化性强于+4价S的氧化性,SeO2、SO2混合气体用水吸收得到H2SO4、Se,反应方程式为:SeO2+2SO2+2H2O=2H2SO4+Se↓,
故答案为:SeO2+2SO2+2H2O=2H2SO4+Se↓;
(6)由图可知,在475℃作用真空蒸馏的挥发物中硒含量最大,故最好选择475℃,
故选:c.
点评 本题考查物质正比工艺流程,为高考常见题型,题目涉及信息获取与迁移运用、物质的分离提纯、对操作与药品的分析评价、条件的选择控制、溶度积有关计算、化学方程式书写等,是对学生综合能力的考查,难度中等.

| A. | 还原剂与氧化产物的物质的量之比为5:8 | |
| B. | 若氧化产物比还原产物多1.4mol则转移电子为1mol | |
| C. | 每生成1.6mol氮气,则有0.2molKNO3被氧化 | |
| D. | NaN3属于硝酸盐 |

| A. | 滤液A中阳离子为Fe2+、H+ | B. | 样品中金属Fe的质量为2.14g | ||
| C. | 样品中CuO的质量为4.0g | D. | V=448 |
| 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | |
| 甲苯 | 92 | -94.9 | 110.6 | 难溶于水 |
| 苯甲酸 | 122 | 122.13 | 249 | 微溶于水 |
在三颈瓶中加入4mL甲苯和20mL稀硫酸,放入碎瓷片后,加热至沸腾,加入12.8g高锰酸钾,加热到甲苯层消失.将三颈瓶在冰水浴中冷却,分离出苯甲酸晶体.
(1)球形冷凝管的作用是冷凝回流,
(2)分离苯甲酸选用的玻璃仪器是BCD(填标号)
A分液漏斗 B玻璃棒 C烧杯 D漏斗 E蒸馏烧瓶 F直形冷凝管
(3)分离出的苯甲酸晶体中可能含有的杂质是KMnO4、K2SO4、MnSO4,为进一步提纯,应采用的方法是重结晶.
实验二:实验室用装置Ⅰ制氨气和氧气的混合气体,A中装有浓氨水,C中盛有碱石灰;用装置Ⅱ验证氨的某些性质,D内放置催化剂(铂石棉),按气流方向①→②→③→④连接各仪器.请回答下列问题:
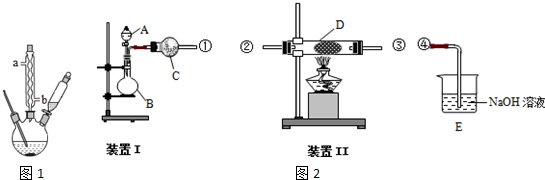
(1)①仪器B中应加入的固体药品Na2O2(填化学式);
②D中发生反应的化学反应方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(2)若用装置Ⅰ制取干燥的SO2气体,则:
①B中发生反应的化学反应方程式为Na2SO3+H2SO4=Na2SO4+H2O+SO2↑;
②此时仪器C中改为盛装P2O5的作用是干燥SO2气体.
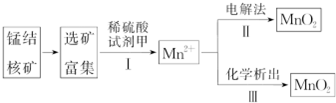
(1)步骤Ⅰ中,试剂甲必须具有的性质是D(填序号).
A.碱性 B.稳定性 C.氧化性 D.还原性
(2)用惰性材料作电极,电解硫酸锰溶液制二氧化锰,写出阳极反应式:Mn2+-2e-+2H2O═MnO2↓+4H+.
步骤Ⅲ中,以KClO3为氧化剂,当生成0.050mol MnO2时,消耗0.10mol•L-1的NaClO3溶液200mL,该反应的离子方程式为2ClO3-+5Mn2++4H2O=5MnO2+Cl2↑+8H+.
(3)用100mL 12.0mol•L-1的浓盐酸与足量MnO2混合后,加热,反应产生的氯气在标准状况下体积范围为V(Cl2)<6720mL.工业上可以用实验室制氯气的残余物质溶液吸收氯气,获得Mn2O3,Mn2O3广泛应用于电子工业、印染工业等领域.请写出该化学反应的离子方程式:2Mn2++Cl2+3H2O═Mn2O3+6H++2Cl-.
(4)二氧化锰是实验室制取氧气的催化剂.下列是某同学设计实验探究双氧水分解实验方案;
| 实验 | 20.0mL双氧水溶液浓度 | 粉状MnO2 | 温度 | 待测数据 |
| Ⅰ | 5% | 2.0g | 20℃ | |
| Ⅱ | 5% | 1.0g | 20℃ | |
| Ⅲ | 10% | 1.0g | 20℃ | |
| Ⅳ | ω | 2.0g | 30℃ |
②利用实验Ⅰ和Ⅳ探究温度对化学反应速率的影响,w=5%.本实验待测数据是收集等体积氧气所需要的时间.
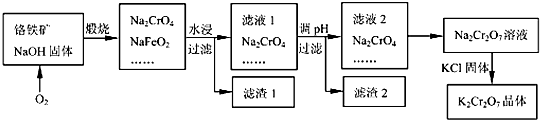
 Cr2O72-+H2O的存在,加稀硫酸增大了H+的浓度,平衡正向移动,使CrO42-浓度减小,Cr2O72-浓度增大,溶液由黄色变为橙色.
Cr2O72-+H2O的存在,加稀硫酸增大了H+的浓度,平衡正向移动,使CrO42-浓度减小,Cr2O72-浓度增大,溶液由黄色变为橙色.
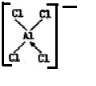 ,[AlCl4]的立体构型名称为正四面体形.
,[AlCl4]的立体构型名称为正四面体形.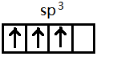 ,铍与铝元素性质相近的原因是Be与Al的电负性相近.
,铍与铝元素性质相近的原因是Be与Al的电负性相近.