题目内容
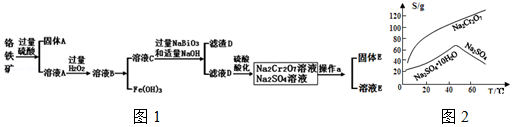
15.重铬酸钾是一种常见的强氧化剂.实验室以精选铬铁矿(主要成分可表示为FeO•Cr2O3,还含有SiO2、Al2O3等杂质)为原料制备重铬酸钾晶体(K2Cr2O7,式量294)的流程如下: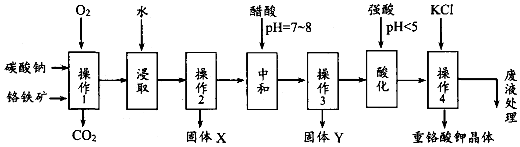
请回答下列问题:
(1)操作1中发生的反应有:4FeO•Cr2O3+8Na2CO3+7O2$\stackrel{一定条件}{→}$8Na2CrO4+2Fe2O3+8CO2↑
Na2CO3+Al2O3$\stackrel{一定条件}{→}$2NaAlO2+CO2↑
Na2CO3+SiO2$\stackrel{一定条件}{→}$Na2SiO3+CO2↑
该步骤在常温下的反应速度较慢,为使反应速率增大,可采取的两条措施是升高温度、将原料粉碎(或使用催化剂).
(2)固体Y中主要含有Al(OH)3、H2SiO3.(填写化学式)
(3)酸化步骤使含铬物质发生了转化,请写出离子反应方程式2CrO42-+2H+=Cr2O72-+H2O.
(4)操作4中的化学反应在溶液中能发生的可能理由是该条件下,K2Cr2O7的溶解度较小;获得K2Cr2O7晶体的操作依次是:加入KCl固体,在水浴上加热浓缩至溶液表面出现晶膜(或溶液中析出固体),冷却结晶,抽滤,洗涤,干燥.
(5)通过下列实验可测定产品中重铬酸钾的质量分数:
称取重铬酸钾试样1.470g,用100mL容量瓶配制成溶液.移取25.00mL溶液于碘量瓶中,加入适里稀硫酸和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min.然后加入一定量的水,加入淀粉指示剂,用0.1500mol/L标准溶液滴定,共消耗标准浓36.00mL.滴定时发生的反应的离子方程式为:I2+2S2O32-=2I-+S4O62-
则所测产品中重铬酸钾的纯度为72%.
(6)有关上述实验过程中涉及的部分实验操作的描述,正确的是AD.
A.粗产品若要进一步提纯,可以采用重结晶的方法
B.配制溶液时,用托盘夭平称取试样后,一般经溶解、转移(含洗涤)、定容等步骤,配制成100mL溶液
C.滴定时,当最后一滴标准溶液滴入时,溶液变为蓝色,且半分钟内不变色,可判断滴定终点
D.滴定终点时俯视读数,测定结果偏低.
分析 铬铁矿、碳酸钠固体通过在氧气中焙烧,生成Na2CrO4、Fe2O3、Na2SiO3、MgO和NaAlO2的混合固体和二氧化碳气体,所以操作1为焙烧,然后加水浸取,过滤得固体Fe2O3、MgO和溶液Na2CrO4、NaAlO2、Na2SiO3,操作2为过滤,固体X为Fe2O3、MgO,再调节溶液的PH到7-8,使偏铝酸盐生成氢氧化铝沉淀,硅酸钠变为硅沉淀,所以固体Y为Al(OH)3、H2SiO3,继续调节溶液的PH使CrO42-转化为Cr2O72-,最后向所得溶液中加入氯化钾,生成溶解度极小的K2Cr2O7,
(1)根据影响反应速率的外界因素可知,升高温度、增大反应物接触面积等都可以增大反应速率;
(2)根据上面的分析可知,固体Y的成份;
(3)结合流程图可知,酸化为了转化CrO42-离子为Cr2O72-,据此书写离子方程式;
(4)操作4是向含Cr2O72-的溶液中加入氯化钾,生成溶解度极小的K2Cr2O7,由易溶物生成难溶物;从K2Cr2O7溶液中获得晶体,要将溶液蒸发浓缩到有少量晶体析出再冷却结晶,据此答题;
(5)根据实验步骤可知,用碘化钾Cr2O72-将还原成Cr3+,根据电子得失守恒有关系式Cr2O72-~3I2,再用Na2S2O3标准溶液滴定( I2+2S2O32-═2I-+S4O62-),根据Na2S2O3的物质的量可计算出样品中K2Cr2O7的物质的量,进而确定样品中K2Cr2O7的纯度;
(6)A.粗产品中可能含有氯化钠杂质,所以若要进一步提纯,可以用重结晶的方法;
B.配制溶液时,用托盘夭平称取试样后,一般经溶解、转移(含洗涤)、定容、摇匀等步骤,配制成100mL溶液;
C.滴定时,用Na2S2O3滴定I2,滴定终点时溶液由蓝色变为无色;
D.滴定终点时俯视读数,测定结果偏低,读取的标准液体积偏小.
解答 解:(1)操作1中为使反应速率增大,可采取的两条措施是升高温度、将原料粉碎(或使用催化剂),
故答案为:升高温度、将原料粉碎(或使用催化剂);
(2)根据上面的分析可知,固体Y的成份为Al(OH)3、H2SiO3,
故答案为:Al(OH)3、H2SiO3;
(3)结合流程图可知,酸化为了转化CrO42-离子为Cr2O72-,反应的离子方程式为2CrO42-+2H+=Cr2O72-+H2O,
故答案为:2CrO42-+2H+=Cr2O72-+H2O;
(4)操作4是向含Cr2O72-的溶液中加入氯化钾,生成溶解度极小的K2Cr2O7,所以该反应在溶液中能发生的可能理由是在该条件下,K2Cr2O7的溶解度较小,从K2Cr2O7溶液中获得晶体,要将溶液蒸发浓缩到有少量晶体析出再冷却结晶,
故答案为:该条件下,K2Cr2O7的溶解度较小;溶液表面出现晶膜(或溶液中析出固体);
(5)根据实验步骤可知,用碘化钾Cr2O72-将还原成Cr3+,根据电子得失守恒有关系式Cr2O72-~3I2,再用Na2S2O3标准溶液滴定( I2+2S2O32-═2I-+S4O62-),所以有关系式Cr2O72-~3I2~6S2O32-,Na2S2O3的物质的量为0.1500mol/L×36.00mL=5.4×10-3 mol,所以样品中K2Cr2O7的物质的量$\frac{1}{6}$×5.4×10-3 mol×$\frac{100mL}{25mL}$=3.6×10-3 mol,样品中K2Cr2O7的纯度为$\frac{3.6×10{\;}^{-3}mol×294g/mol}{1.470g}$×100%=72%,
故答案为:72%;
(6)A.粗产品中可能含有氯化钠杂质,所以若要进一步提纯,可以用重结晶的方法,故A正确;
B.配制溶液时,用托盘夭平称取试样后,一般经溶解、转移(含洗涤)、定容、摇匀等步骤,配制成100mL溶液,故B错误;
C.滴定时,用Na2S2O3滴定I2,滴定终点时溶液由蓝色变为无色,故C错误;
D.滴定终点时俯视读数,测定结果偏低,读取的标准液体积偏小,所以测得的结果偏低,故D正确,
故选AD.
点评 本题考查了物质制备流程和方案的分析判断,物质性质的应用,题干信息的分析理解,操作步骤的注意问题和基本操作方法是解题关键,题目难度中等.

| A. | 钢铁生锈 | B. | 食物腐烂 | C. | 呼吸作用 | D. | 蜡烛燃烧 |
| A. | 还原剂与氧化产物的物质的量之比为5:8 | |
| B. | 若氧化产物比还原产物多1.4mol则转移电子为1mol | |
| C. | 每生成1.6mol氮气,则有0.2molKNO3被氧化 | |
| D. | NaN3属于硝酸盐 |
| A. | 钢是铁合金,钢的含碳量低于生铁,性能优于生铁 | |
| B. | 金属具有的物理通性是延展性、导热性、银白色光泽、导电性 | |
| C. | 符号Al既能表示铝元素,又能表示一个铝原子,还能表示铝单质 | |
| D. | 焊锡是锡铅合金,把铅加入锡中制成合金的主要目的是降低熔点 |

| A. | 滤液A中阳离子为Fe2+、H+ | B. | 样品中金属Fe的质量为2.14g | ||
| C. | 样品中CuO的质量为4.0g | D. | V=448 |
| 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | |
| 甲苯 | 92 | -94.9 | 110.6 | 难溶于水 |
| 苯甲酸 | 122 | 122.13 | 249 | 微溶于水 |
在三颈瓶中加入4mL甲苯和20mL稀硫酸,放入碎瓷片后,加热至沸腾,加入12.8g高锰酸钾,加热到甲苯层消失.将三颈瓶在冰水浴中冷却,分离出苯甲酸晶体.
(1)球形冷凝管的作用是冷凝回流,
(2)分离苯甲酸选用的玻璃仪器是BCD(填标号)
A分液漏斗 B玻璃棒 C烧杯 D漏斗 E蒸馏烧瓶 F直形冷凝管
(3)分离出的苯甲酸晶体中可能含有的杂质是KMnO4、K2SO4、MnSO4,为进一步提纯,应采用的方法是重结晶.
实验二:实验室用装置Ⅰ制氨气和氧气的混合气体,A中装有浓氨水,C中盛有碱石灰;用装置Ⅱ验证氨的某些性质,D内放置催化剂(铂石棉),按气流方向①→②→③→④连接各仪器.请回答下列问题:
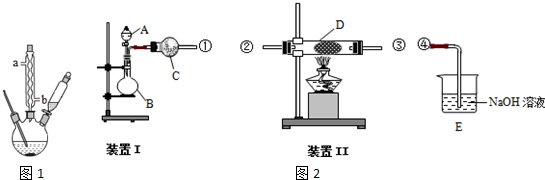
(1)①仪器B中应加入的固体药品Na2O2(填化学式);
②D中发生反应的化学反应方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(2)若用装置Ⅰ制取干燥的SO2气体,则:
①B中发生反应的化学反应方程式为Na2SO3+H2SO4=Na2SO4+H2O+SO2↑;
②此时仪器C中改为盛装P2O5的作用是干燥SO2气体.
 ,砷属于p区元素.
,砷属于p区元素.