题目内容
8.资料显示,某些金属离子对H2O2的分解起催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,该实验小组的同学设计了如图1所示的实验装置进行实验.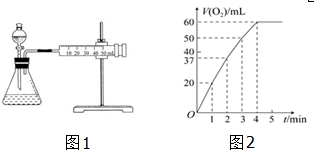
(1)某同学通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量单位时间生成O2的体积(或生成单位体积O2所需要的时间)_ (或_ )来比较.
(2)0.1g MnO2粉末加入50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图2所示.解释反应速率变化的原因:随着反应的进行,浓度减小,反应速率减慢.
(3)根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法不正确的是C(填序号).
A.化学反应速率理论可以指导怎样在一定时间内快出产品
B.勒夏特列原理可以指导怎样使有限原料多出产品
C.催化剂的使用是提高产品产率的有效办法
D.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益.
分析 (1)实验时可以通过测量单位时间生成O2的体积或生成单位体积O2所需要的时间来比较;
(2)随着反应的进行,溶液的浓度逐渐降低,反应速率逐渐减慢;
(3)A.化学反应速率,表示反应快慢物理量,可以指导在一定时间内快出产品;
B.勒夏特列原理即平衡移动原理可指导怎样使用有限原料多出产品;
C.催化剂的使用只能提高反应速率;
D.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益.
解答 解:(1)通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量单位时间生成O2的体积或生成单位体积O2所需要的时间来比较,
故答案为:单位时间生成O2的体积或生成单位体积O2所需要的时间;
(2)浓度越大,反应速率越大,反之越小,随着反应进行,反应物的浓度逐渐减小,则速率逐渐减小;
故答案为:随着反应的进行,浓度减小,反应速率减慢;
(3)A.化学反应速率,表示反应快慢物理量,故A正确;
B.勒夏特列原理是平衡移动原理,可指导怎样使用有限原料多出产品,故B正确;
C.催化剂的使用提高反应速率,不能改变产量,只能缩短到达平衡时间,故C错误;
D.综合经济效益既考虑原料的利用率又要考虑时间,故D正确;
故答案为:C.
点评 本题考查了化学反应速率的影响因素以及化学平衡移动原理,明确影响化学反应速率的因素以及化学平衡移动原理为解答关键,注意催化剂只能加快化学反应速率,不能改变化学反应的限度.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.烃类分子中的碳原子的共用电子对数是( )
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
11.有机物A的相对分子质量不超过150,经测定A具有下列性质:
(1)填写表中空白.
(2)若A分子中氧元素的质量分数为59.7%,则A的分子式为C4H6O5.
(3)若A分子中无含碳支链,写出反应③的化学方程式: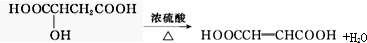 .
.
(4)下列物质与A互为同系物的是b(填字母).
a.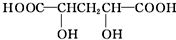
b.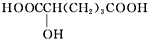
c.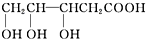
d.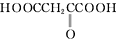
| A的性质 | 推断A的组成、结构 |
| ①能燃烧,燃烧产物只有CO2和H2O | 一定含有C、H元素,可能含有O元素 |
| ②A与醇或羧酸在浓硫酸存在下均能生成有香味的物质 | A分子中含有-OH、-COOH |
| ③在一定条件下,A能发生分子内脱水反应,其生成物与溴水混合,溴水褪色 | - |
| ④0.1mol A与足量NaHCO3溶液反应产生4.48L(标准状况下)气体 | A分子中含有两个-COOH |
(2)若A分子中氧元素的质量分数为59.7%,则A的分子式为C4H6O5.
(3)若A分子中无含碳支链,写出反应③的化学方程式:
 .
.(4)下列物质与A互为同系物的是b(填字母).
a.
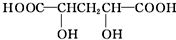
b.
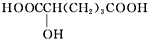
c.

d.
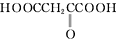
8.下列有关NH4Al(SO4)2溶液的叙述正确的是( )
| A. | 该溶液中Na+、Mg2+、AlO${\;}_{2}^{-}$、NO${\;}_{3}^{-}$可以大量共存 | |
| B. | 通入CO2气体产生白色沉淀 | |
| C. | 通入H2S气体无明显现象,原因是二者不反应 | |
| D. | 与少量Ba(OH)2溶液反应的离子方程式:Al3++2SO${\;}_{4}^{2-}$+2Ba2++3OH-=2BaSO4↓+Al(OH)3↓ |
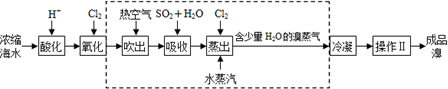
20.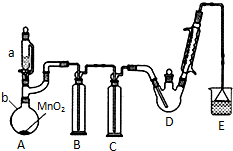 某探究小组设计如右图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验. 查阅资料,有关信息如图:
某探究小组设计如右图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验. 查阅资料,有关信息如图:
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O
CCl3CHO+HClO→CCl3COOH+HCl
(三氯乙酸)
②相关物质的部分物理性质:
(1)仪器b的名称为圆底烧瓶,装置B中的试剂是饱和食盐水,装置A中发生反应的化学方程式是MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)装置C的作用为除去氯气中混有的H2O,减少三氯乙酸的生成;装置D可采用水浴加热的方法以控制反应温度在70℃左右.
(3)反应结束后,不能采取先将D中的混合物冷却到室温,再用过滤的方法分离出CCl3COOH的原因为CCl3COOH溶于乙醇与CCl3CHO.
(4)装置E中溶液为NaOH溶液,可能发生的无机反应的离子方程式有Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O.
(5)测定产品纯度:称取产品0.30g配成待测溶液,加入0.1000mol•L-1碘标准溶液20.00mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000mol•L-1 Na2S2O3溶液滴定至终点.进行平行实验后,测得消耗Na2S2O3溶液20.00mL.则产品的纯度为88.5%.(CCl3CHO的相对分子质量为147.5)
滴定的反应原理如下:CCl3CHO+OH-=CHCl3+HCOO-HCOO-+I2=H++2I-+CO2↑
I2+2S2O32-=2I-+S4O62-
(6)已知:常温下Ka(CCl3COOH)=1.0×10-1 mol•L-1,Ka (CH3COOH)=1.7×10-5 mol•L-1
请设计实验证明三氯乙酸、乙酸的酸性强弱.
分别测定0.1 mol•L-1两种酸溶液的pH,三氯乙酸的pH较小,证明三氯乙酸的酸性强于乙酸.
 某探究小组设计如右图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验. 查阅资料,有关信息如图:
某探究小组设计如右图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验. 查阅资料,有关信息如图:①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O
CCl3CHO+HClO→CCl3COOH+HCl
(三氯乙酸)
②相关物质的部分物理性质:
| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水、可溶于乙醇 |
(2)装置C的作用为除去氯气中混有的H2O,减少三氯乙酸的生成;装置D可采用水浴加热的方法以控制反应温度在70℃左右.
(3)反应结束后,不能采取先将D中的混合物冷却到室温,再用过滤的方法分离出CCl3COOH的原因为CCl3COOH溶于乙醇与CCl3CHO.
(4)装置E中溶液为NaOH溶液,可能发生的无机反应的离子方程式有Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O.
(5)测定产品纯度:称取产品0.30g配成待测溶液,加入0.1000mol•L-1碘标准溶液20.00mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000mol•L-1 Na2S2O3溶液滴定至终点.进行平行实验后,测得消耗Na2S2O3溶液20.00mL.则产品的纯度为88.5%.(CCl3CHO的相对分子质量为147.5)
滴定的反应原理如下:CCl3CHO+OH-=CHCl3+HCOO-HCOO-+I2=H++2I-+CO2↑
I2+2S2O32-=2I-+S4O62-
(6)已知:常温下Ka(CCl3COOH)=1.0×10-1 mol•L-1,Ka (CH3COOH)=1.7×10-5 mol•L-1
请设计实验证明三氯乙酸、乙酸的酸性强弱.
分别测定0.1 mol•L-1两种酸溶液的pH,三氯乙酸的pH较小,证明三氯乙酸的酸性强于乙酸.
18.质子数≤18的A和M两种元素,已知A2-与M+的电子数之差为8,则下列说法正确的是( )
| A. | A和M原子的最外层电子数之差不一定为5 | |
| B. | A和M原子的最外层电子数之和一定为7 | |
| C. | A和M原子的电子数之差一定为11 | |
| D. | A和M的原子序数之差不一定为5 |