题目内容
13.溴化钙可用于石油钻井,也可用于制造溴化铵及光敏纸、灭火剂、制冷剂等.制备CaBr2•2H2O的主要流程如下: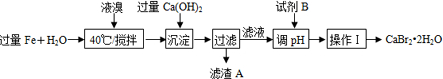
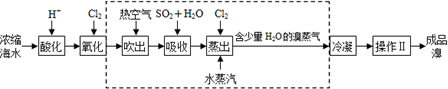
工业提取液溴主要采用空气吹出法,其主要流程如下
请回答:
(1)Fe与液溴的反应温度不能超过40℃的原因是防止液溴挥发,降低原料利用率.
(2)试剂B最好选用HBr.
(3)操作Ⅰ的步骤为蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(4)下列说法中错误的是bd.
a.滤渣A的成分可能是Fe、Fe(OH)2、Fe(OH)3;
b.操作Ⅱ的名称是萃取
c.流程图中虚线框部分步骤的主要目的是除去杂质、富集Br2
d.成品溴中含有的少量Cl2,可加入Na2SO3溶液,然后分液除去
(5)制得的CaBr2•2H2O可以通过以下方法测定纯度:称取5.00g样品溶于水,滴入足量Na2CO3溶液,充分反应后过滤,将沉淀洗涤、烘干、冷却、称量,得到2.00g固体.
①纯度测定中用到的玻璃仪器有胶头滴管、酒精灯、烧杯、玻璃棒、漏斗.
②洗涤沉淀的操作方法是向过滤器中加入蒸馏水至没过沉淀表面,静置待水自然流下,重复2~3次.
③测得CaBr2•2H2O的质量分数为94.40%.
分析 根据反应流程,液溴中加入过量铁粉和水生成溴化亚铁,再加入氢氧化钙,氢氧化钙和溴化亚铁反应生成溴化钙和氢氧化亚铁,过滤得到滤液为溴化钙溶液,滤渣为氢氧化亚铁,部分氢氧化亚铁可能被氧化成氢氧化铁,溴化钙溶液中加入HBr加热蒸发浓缩冷却结晶得到CaBr2•2H2O,测定CaBr2•2H2O纯度,可用CaBr2与碳酸钠反应生成碳酸钙沉淀,根据碳酸钙的质量可计算出CaBr2的质量,进而确定质量分数,结合相关实验基本操作答题;
工业提取液溴主要采用空气吹出法,其主要流程为海水浓缩后用氯气和溴化钠可以置换出溴单质,用热空气吹出,再用亚硫酸溶液吸收,再用氯气氧化后用热水蒸汽吹出,得到含有少量水的溴,再干燥可得成品溴,据此答题.
解答 解:根据反应流程,液溴中加入过量铁粉和水生成溴化亚铁,再加入氢氧化钙,氢氧化钙和溴化亚铁反应生成溴化钙和氢氧化亚铁,过滤得到滤液为溴化钙溶液,滤渣为氢氧化亚铁,部分氢氧化亚铁可能被氧化成氢氧化铁,溴化钙溶液中加入HBr加热蒸发浓缩冷却结晶得到CaBr2•2H2O,测定CaBr2•2H2O纯度,可用CaBr2与碳酸钠反应生成碳酸钙沉淀,根据碳酸钙的质量可计算出CaBr2的质量,进而确定质量分数,
(1)因为溴易挥发,会降低原料利用率,所以Fe与液溴的反应温度不能超过40℃同,
故答案为:防止液溴挥发,降低原料利用率;
(2)根据上面的分析可知,试剂B最好选用HBr,
故答案为:HBr;
(3)操作Ⅰ为从溴化钙溶液中获得溴化钙晶体,实验的步骤为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,
故答案为:冷却结晶、过滤;
(4)a.根据上面的分析可知,滤渣A的成分可能是Fe、Fe(OH)2、Fe(OH)3,故a正确;
b.根据上面的分析可知,操作Ⅱ的名称是干燥,故b错误;
c.根据上面的分析可知,流程图中虚线框部分步骤的主要目的是除去杂质、富集Br2,故c正确;
d.因为Na2SO3溶液能与溴反应,所以不能用Na2SO3溶液除氯气,故d错误;
故选bd;
(5)①根据碳酸钙的质量可计算出CaBr2的质量,进而确定质量分数,所以在溴化钙溶液中加入碳酸钠溶液生成 沉淀,沉淀洗涤、烘干、冷却、称量,用到的玻璃仪器有胶头滴管、酒精灯、烧杯、玻璃棒、漏斗,
故答案为:烧杯、玻璃棒、漏斗;
②洗涤沉淀的操作方法是向过滤器中加入蒸馏水至没过沉淀表面,静置待水自然流下,重复2~3次,
故答案为:向过滤器中加入蒸馏水至没过沉淀表面,静置待水自然流下,重复2~3次;
③根据题意,测得CaCO3的质量为2.00g,根据关系式CaBr2•2H2O~CaCO3可知,CaBr2•2H2O的质量为$236×\frac{2.0}{100}$g=4.72g,所以CaBr2•2H2O的质量分数为$\frac{4.72}{5}$×100%=94.40%,
故答案为:94.40%.
点评 本题考查了溴化钙晶体的制备实验方案设计,题目涉及化学实验基本操作、除杂质、含量的计算等,题目难度中等,是对学生综合能力的考查,需要学生基本扎实的基础与分析问题、解决问题的能力.

| A. | 除去溴苯中的溴,可加入过量的KI溶液后分液 | |
| B. | 葡萄糖、蔗糖都能与新制氢氧化铜浊液发生反应 | |
| C. | 蛋白质水解的最终产物既能和强酸反应,又能和强碱反应 | |
| D. | 纤维素属于高分子化合物,与淀粉互为同分异构体 |
| A. | 称取5 g左右的干海带--托盘天平 | |
| B. | 灼烧干海带至完全变成灰烬--坩埚 | |
| C. | 过滤煮沸后的海带灰和水的混合物--漏斗 | |
| D. | 用四氯化碳从氧化后的海带灰浸取液中提取碘--长颈漏斗 |
| A. | Q1+Q2=92.4 | |
| B. | 达平衡时甲、乙中NH3的体积分数乙>甲 | |
| C. | 达到平衡后,再向乙中加入0.25mol N2(g)、0.75mol H2(g)和1.5mol NH3(g),平衡向生成N2的方向移动 | |
| D. | 达平衡时甲中N2的转化率为25% |
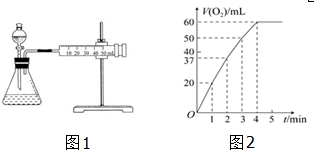
| t/min | 0 | 2 | 4 | 6 | 8 |
| V(O2)/mL | 0 | 9.9 | 17.2 | 22.4 | 26.5 |
(1)6min内过氧化氢的分解速率.(精确到0.01)
(2)6min内过氧化氢分解的转化率.
(3)6min内过氧化氢的物质的量浓度.
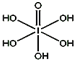 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.(1)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是氢键.
(2)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是I.
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(4)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大这是由于溶液中发生下列反应I-+I2=I3-.I3-离子的中心原子周围σ键电子对对数为2.与KI3类似的,还有CsICl2等.已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列A式发生.
A.CsICl2=CsCl+ICl B.CsICl2=CsI+Cl2
(5)已知CaF2晶体的密度为ρg/cm3,NA为阿伏加德罗常数,CaF2晶胞的边长为a pm,则CaF2的相对分子质量可以表示为$\frac{{a}^{3}×ρ×1{0}^{-30}×{N}_{A}}{4}$(用含a的式子表示).
①V(A)=0.15mol/(L•s)
②V(B)=36mol/(L•min)
③V(C)=0.5mol/(L•s)
④V(D)=0.45mol/(L•s)
| A. | ④>③>①>② | B. | ④>③>②>① | C. | ②>③>④>① | D. | ②>④>③>① |