题目内容
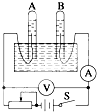 如图所示为电解水的装置,闭合开关S后,观察到电压表示数为6.0V,电流表示数为100mA.
如图所示为电解水的装置,闭合开关S后,观察到电压表示数为6.0V,电流表示数为100mA.(1)此时A管内生成
A极:
(2)为加快电解水的速率,可在水中加入
A.H2SO4 B.HClC.NaOHD.NaCl.
考点:电解原理
专题:
分析:(1)装置图分析可知与电源正极连接的B为电解池阳极,水溶液中氢氧根离子失电子生成氧气,与电源负极连接的电极A为电解池的阴极,水溶液中氢离子得到电子生成氢气;
(2)加快电解速率可以加入含氧酸,或强碱溶液增加离子浓度增大导电性;
(2)加快电解速率可以加入含氧酸,或强碱溶液增加离子浓度增大导电性;
解答:
解:(1)装置图分析可知与电源正极连接的B为电解池阳极,水溶液中氢氧根离子失电子生成氧气,电极反应为:4OH--4e-=2H2O+O2↑;与电源负极连接的电极A为电解池的阴极,水溶液中氢离子得到电子生成氢气,电极反应为:2H++2e-=H2↑;
故答案为:H2;O2;2H++2e-=H2↑;4OH--4e-=2H2O+O2↑;
(2)加快电解速率可以加入含氧酸,或强碱溶液增加离子浓度增大导电性;
A.加入H2S04,电解过程实质电解水,但增加了离子浓度,溶液导电性增大,故A正确;
B.加入HCl,电解过程中阳极氯离子失电子生成氯气,实质电解氯化氢,不是电解水,故B错误;
C.加入NaOH实质电解水,但增大了离子浓度,导电性增强,故C正确;
D.加入NaCl,阳极是氯离子失电子生成氯气,实质电解氯化钠和水,不是电解水,故D错误;
故答案为:AC.
故答案为:H2;O2;2H++2e-=H2↑;4OH--4e-=2H2O+O2↑;
(2)加快电解速率可以加入含氧酸,或强碱溶液增加离子浓度增大导电性;
A.加入H2S04,电解过程实质电解水,但增加了离子浓度,溶液导电性增大,故A正确;
B.加入HCl,电解过程中阳极氯离子失电子生成氯气,实质电解氯化氢,不是电解水,故B错误;
C.加入NaOH实质电解水,但增大了离子浓度,导电性增强,故C正确;
D.加入NaCl,阳极是氯离子失电子生成氯气,实质电解氯化钠和水,不是电解水,故D错误;
故答案为:AC.
点评:本题考查了电解原理的分析应用,电解反应和电极产物分析,题目难度不大.注意电解池阳极上失电子发生氧化反应,阴极发生还原反应.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
对于反应:N2+O2?2NO,在密闭容器中进行,下列条件能加快反应速率的是( )
| A、降低温度,使平衡正向移动 |
| B、体积不变充入N2使压强增大 |
| C、体积不变充入He使气体压强增大 |
| D、保持总压强不变,充入Ne气体 |
下列转化不能一步实现的是( )
| A、CuO→Cu(OH)2 |
| B、CuSO4→Cu |
| C、CaCO3→CaO |
| D、MgSO4→MgCl2 |
 Na2O2是中学化学常用的强氧化剂,除了能与CO2、H2O反应外,还可与其他还原剂如H2、C发生反应,某化学课外兴趣小组为探究Na2O2与H2的反应情况,设计了如图所示装置进行有关实验.
Na2O2是中学化学常用的强氧化剂,除了能与CO2、H2O反应外,还可与其他还原剂如H2、C发生反应,某化学课外兴趣小组为探究Na2O2与H2的反应情况,设计了如图所示装置进行有关实验. 铁合金中常含有碳,铁、碳材料在日常生活、工业生产和科学研究中具有极其重要的用途.回答以下问题:
铁合金中常含有碳,铁、碳材料在日常生活、工业生产和科学研究中具有极其重要的用途.回答以下问题: