题目内容
 铁合金中常含有碳,铁、碳材料在日常生活、工业生产和科学研究中具有极其重要的用途.回答以下问题:
铁合金中常含有碳,铁、碳材料在日常生活、工业生产和科学研究中具有极其重要的用途.回答以下问题:(1)铁元素基态原子核外未成对电子数有
(2)足球烯(C60)熔沸点较低,硬度较小,易溶于苯、酒精等有机溶剂,不导电.C60的晶体类型是
(3)低温条件下合成金刚石的反应如下:4Na+3CO 2
| ||
上述反应中四种物质按照熔点由高到低的顺序是
该反应中涉及的元素按电负性从大到小的顺序是
(4)以丙烯腈为原料可制得质轻、有很高的抗拉强度和弹性的聚丙烯腈碳纤维,该纤维广泛应用于制造高级文体用品.丙烯腈(CH2=CH-C≡N)分子中,σ键和π键的个数比为
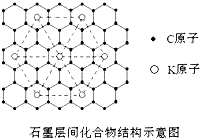
(5)石墨层间化合物在电池材料、储氢材料等方面具有广阔应用前景.某种石墨层间化合物是在石墨层间插入钾,其结构如图所示.该化合物化学式为
考点:晶胞的计算,原子核外电子排布,元素电离能、电负性的含义及应用,原子轨道杂化方式及杂化类型判断
专题:
分析:(1)铁是26号元素,电子排布式为1s22s22p63s23p663d6 4s2,d能级上有未成对电子;
(2)根据各类型晶体的性质可判断;
(3)物质熔点可根据晶体类型判断,原子晶体的>离子晶体>金属晶体>分子晶体;
同一周期元素电负性从左到右渐增,同一主族元素电负性从上到下逐渐减小;
(4)根据杂化轨道数=σ键数目+孤对电子对数,确定杂化轨道;根据1个单键是1个σ键,一个双键含有1个σ键和1个π键,一个三键含有1个σ键和2个π键;
(5)利用均摊法计算碳原子和钾原子个数之比,注意每个钾原子被六个三角形共用很关键.
(2)根据各类型晶体的性质可判断;
(3)物质熔点可根据晶体类型判断,原子晶体的>离子晶体>金属晶体>分子晶体;
同一周期元素电负性从左到右渐增,同一主族元素电负性从上到下逐渐减小;
(4)根据杂化轨道数=σ键数目+孤对电子对数,确定杂化轨道;根据1个单键是1个σ键,一个双键含有1个σ键和1个π键,一个三键含有1个σ键和2个π键;
(5)利用均摊法计算碳原子和钾原子个数之比,注意每个钾原子被六个三角形共用很关键.
解答:
解:(1)铁是26号元素,电子排布式为1s22s22p63s23p663d6 4s2,根据泡利原理和洪特规则知d能级上有未成对电子,由于d能级有5个轨道,d能级有4个未成对电子,故答案为:4;
(2)足球烯(C60)熔沸点较低,硬度较小,易溶于苯、酒精等有机溶剂,属于分子晶体,故答案为:分子晶体;
(3)金刚石为原子晶体,碳酸钠为离子晶体,金属钠为金属晶体,二氧化碳为分子晶体,故其熔点大小顺序为C>Na2CO3>Na>CO2;
同一周期元素电负性从左到右渐增,同一主族元素电负性从上到下逐渐减小,电负性从大到小的顺序是O>C>Na;
故答案为:C>Na2CO3>Na>CO2;O>C>Na;
(4)丙烯腈(CH2=CH-C≡N)分子中含有6个σ键和3个π键,数目之比为 2:1;
丙烯腈分子CH2=CH-CN中双键上的碳原子形成3个σ键,无孤电子对,sp2杂化,与氮相连的碳原子形成2个σ键,无孤电子对,sp杂化;
故答案为:2:1;sp2杂化、sp杂化;
(5)可以取三个钾原子形成的小三角形为计算单位,其完全占有的碳原子数是4,占有的钾原子数为
×3=
,碳原子数和钾原子数之比是4:
=8:1,该化合物化学式为C8K,故答案为:C8K.
(2)足球烯(C60)熔沸点较低,硬度较小,易溶于苯、酒精等有机溶剂,属于分子晶体,故答案为:分子晶体;
(3)金刚石为原子晶体,碳酸钠为离子晶体,金属钠为金属晶体,二氧化碳为分子晶体,故其熔点大小顺序为C>Na2CO3>Na>CO2;
同一周期元素电负性从左到右渐增,同一主族元素电负性从上到下逐渐减小,电负性从大到小的顺序是O>C>Na;
故答案为:C>Na2CO3>Na>CO2;O>C>Na;
(4)丙烯腈(CH2=CH-C≡N)分子中含有6个σ键和3个π键,数目之比为 2:1;
丙烯腈分子CH2=CH-CN中双键上的碳原子形成3个σ键,无孤电子对,sp2杂化,与氮相连的碳原子形成2个σ键,无孤电子对,sp杂化;
故答案为:2:1;sp2杂化、sp杂化;
(5)可以取三个钾原子形成的小三角形为计算单位,其完全占有的碳原子数是4,占有的钾原子数为
| 1 |
| 6 |
| 1 |
| 2 |
| 1 |
| 2 |
点评:本题考查了核外电子排布、电负性、杂化类型判断和晶胞计算等内容,注意C8K的化学式判断,选取正确的结构为计算单位是解答的关键,难度较大.

练习册系列答案
相关题目
下列物质能与水反应生成强酸的是( )
| A、Na2O2 |
| B、CO2 |
| C、SO3 |
| D、NH3 |
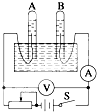 如图所示为电解水的装置,闭合开关S后,观察到电压表示数为6.0V,电流表示数为100mA.
如图所示为电解水的装置,闭合开关S后,观察到电压表示数为6.0V,电流表示数为100mA.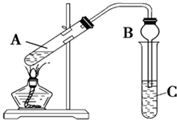 某兴趣小组利用如图装置,将不同浓度的硫酸与3mL 无水乙醇和2mL冰醋酸混合,分别进行制取乙酸乙酯的研究.
某兴趣小组利用如图装置,将不同浓度的硫酸与3mL 无水乙醇和2mL冰醋酸混合,分别进行制取乙酸乙酯的研究.



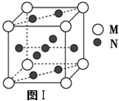 ,则该合金中M和N的原子个数比为
,则该合金中M和N的原子个数比为 ,其中M离子的配位数是
,其中M离子的配位数是