题目内容
5.工业纯碱中常含有少量NaCl,某校化学课外活动小组设计并完成了如下实验.【实验目的】
测定工业纯碱中Na2CO3的含量.
【实验原理】
Na2CO3与酸反应生成的CO2被吸收剂吸收,通过分别称量反应前、后的U形干燥管E的总质量,求出Na2CO3的含量.
【实验装置】

【实验试剂】
①NaOH溶液 ②饱和石灰水 ③碱石灰 ④无水氯化钙 ⑤无水硫酸铜⑥浓盐酸 ⑦稀盐酸 ⑧浓硫酸 ⑨稀硫酸 ⑩试样(工业纯碱)
【实验步骤】(完成下列实验步骤)
①称量试样及装有吸收剂的E的质量,记录数据;
②如上图所示连接好装置,先检查装置的气密性;
③在有关仪器中装入适当试剂;
④打开甲、乙弹簧夹,用气卿鼓入空气,然后接上已称量过的E;
⑤关闭弹簧夹甲,打开乙,将稀H2SO4滴加到装有试样的试剂瓶中;
⑥反应完全后,打开弹簧夹甲和乙,用气卿鼓气一段时间;
⑦称量E的质量并记录数据.
(1)实验时,在仪器D中装入浓硫酸的作用是吸收CO2中的H2O,在仪器C中应装入的试剂是⑨.(填试剂序号)
(2)实验过程中,先、后共两次鼓入空气,第二次鼓入空气的目的是驱赶残留在装置中的CO2,以使其完全被吸收.
(3)某同学认为在E装置后应再连接F装置(装有适当试剂),你认为是否必要?必要.(选填“必要”或“不必要”)
分析 依据实验步骤⑤是需要关闭甲打开乙B中稀硫酸和样品反应生成二氧化碳气体;
⑥反应完全后,需要打开甲乙,把装置中生成的二氧化碳全部赶入E装置吸收;
(1)装置D中需要用浓硫酸干燥二氧化碳气体减少实验误差,装置C是稀硫酸,目的是和样品中碳酸钠反应生成二氧化碳气体;
(2)实验过程中,先、后共两次鼓入空气,第二次鼓入空气的目的是把生成的二氧化碳全部赶出吸收减少实验误差;
(3)E装置连接F可以避免空气中的二氧化碳水蒸气被E吸收产生误差;
解答 解:⑤依据实验步骤⑤是需要关闭甲打开乙B中稀硫酸和样品反应生成二氧化碳气体;
故答案为:关闭弹簧夹甲,打开乙,将稀H2SO4滴加到装有试样的试剂瓶中;
⑥反应完全后,需要打开甲乙,把装置中生成的二氧化碳全部赶入E装置吸收;
故答案为:反应完全后,打开弹簧夹甲和乙,用气卿鼓气一段时间;
(1)装置D中需要用浓硫酸干燥二氧化碳气体减少实验误差,装置C是稀硫酸,目的是和样品中碳酸钠反应生成二氧化碳气体;
故答案为:吸收CO2中的H2O,⑨;
(2)实验过程中,先、后共两次鼓入空气,第二次鼓入空气的目的是把生成的二氧化碳全部赶出吸收减少实验误差;
故答案为:驱赶残留在装置中的CO2,以使其完全被吸收;
(3)在E装置后应再连接F装置,可以利用碱石灰吸收水蒸气和二氧化碳,避免空气中的水蒸气和二氧化碳被E吸收产生误差;
故答案为:必要;
点评 本题考查了探究物质性质的实验设计和实验验证方法的分析判断,掌握实验基础和物质性质是解题关键,题目难度中等.

练习册系列答案
相关题目
15.设NA 为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1 mol•L-1的NaClO溶液中所含ClO-的数目为NA | |
| B. | 标准状况下,2.24 L乙醇中含有的C-H数目为0.5NA | |
| C. | 常温常压下,65 g Zn与足量浓H2SO4充分反应,转移电子数一定为2NA | |
| D. | 2.24 L NO与1.12 L O2充分反应所得气体中原子数目一定为0.3NA |
16.下列说法不正确的是( )
| A. | 硬脂酸甘油酯在NaOH溶液中水解完全后,加入饱和食盐水,下层析出硬脂酸钠 | |
| B. | 天然高分子化合物淀粉或纤维素最终的水解产物都是葡萄糖 | |
| C. | 鸡蛋清的溶液中加入福尔马林溶液,鸡蛋清凝聚,蛋白质变性 | |
| D. | 不同种类的氨基酸能以不同的数目和顺序彼此结合,形成更复杂的多肽化合物 |
10.用铝箔包裹0.1mol金属钠,用针孔扎出一些小孔,将其放入水中充分反应,下列有关叙述正确的是( )
| A. | 反应生成了1.12L(标准状况)H2 | |
| B. | 向反应后的溶液中加入足量小苏打,最终有白色沉淀生成 | |
| C. | 在反应后的溶液中一定能大量共存的粒子有:K+、Mg2+、I-、NO3- | |
| D. | 向反应后的溶液中加入足量稀硫酸,最终有白色沉淀生成 |


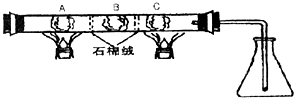 在一硬质玻璃管中进行如图所示的实验,图中A为NH4HCO3,B为Na2O2,C为Pt丝;石棉绒起隔离药品的作用.充分反应后,发现锥形瓶内出现红棕色气体,随之又有白烟产生.
在一硬质玻璃管中进行如图所示的实验,图中A为NH4HCO3,B为Na2O2,C为Pt丝;石棉绒起隔离药品的作用.充分反应后,发现锥形瓶内出现红棕色气体,随之又有白烟产生.
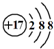 .
.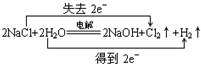 .
.