题目内容
9.对于已达到平衡的可逆反应:A(g)?2B(?)+C(g)△H>0,假设A、C状态保持不变,下列说法正确的是( )| A. | 当混合气体的质量不变,说明反应已达平衡状态 | |
| B. | 缩小容器体积,重新达到平衡时,气体混合物中C%可能增大 | |
| C. | 在恒压容器中升高温度,气体混合物中C%可能先增大后减小 | |
| D. | 在恒容容器中升高温度,达到新平衡时,气体的密度增大 |
分析 A.若B为气体,则混合气体的质量始终不变;
B.若B为固体,缩小容器体积,平衡不移动;若B为气体,缩小容器体积,平衡逆向移动;
C.该反应为吸热反应,升高温度正向移动;
D.该反应为吸热反应,升高温度正向移动,结合B的状态判断.
解答 解:A.若B为气体,则反应过程中气体的总质量始终不变,不能根据总质量判断平衡状态,故A错误;
B.若B为固体,缩小容器体积,平衡不移动,气体混合物中C%不变;若B为气体,缩小容器体积,则增大压强,平衡逆向移动,气体混合物中C%减小,故B错误;
C.若B为液体,该反应为吸热反应,升高温度正向移动,C的物质的量增大,则气体混合物中C%增大,当B由液体变为气体时,C%会减小,故C正确;
D.该反应为吸热反应,升高温度正向移动,若B为气体,气体的总质量不变,则气体的密度不变,若B为固体,则气体的总质量减小,所以密度减小,故D错误;
故选C.
点评 本题考查了化学平衡的影响因素、化学平衡状态的判断,题目难度不大,注意把握浓度、温度、压强等对化学平衡的影响以及化学平衡状态的判断方法.

练习册系列答案
相关题目
2.与下列环境问题对应的物质不正确的是( )
| A. | 温室效应---二氧化碳 | B. | 光化学烟雾---二氧化氮 | ||
| C. | 酸雨---二氧化碳 | D. | 臭氧层破坏---氟氯烃 |
3.有人常用废旧报纸包装食品,这是极不卫生的.原因是报纸上除含有多种病菌外,还会含有易使人中毒的多氯联苯和( )
| A. | 铅 | B. | 机油 | C. | 三氯化锑 | D. | 硫 |
4.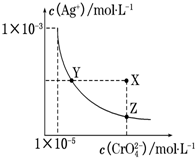 在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示. 又知AgCl的Ksp=1.8×10-10.下列说法正确的是( )
在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示. 又知AgCl的Ksp=1.8×10-10.下列说法正确的是( )
 在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示. 又知AgCl的Ksp=1.8×10-10.下列说法正确的是( )
在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示. 又知AgCl的Ksp=1.8×10-10.下列说法正确的是( )| A. | t℃时,Ag2CrO4的Ksp为1×10-8 | |
| B. | 在饱和Ag2CrO4溶液中加入K2CrO4能使溶液由Y点变为X点 | |
| C. | t℃时,Y点和Z点时Ag2CrO4的Ksp相等 | |
| D. | t℃时,将0.01 mol•L-1 AgNO3溶液滴入20 mL 0.01 mol•L-1 KCl和0.01 mol•L-1 K2CrO4的混合溶液中,CrO42-先沉淀 |
18.下列说法正确的是( )
| A. | 已知某温度下纯水中的c(H+)=2×l0-7mol/L,据此无法求出水中c(OH-) | |||||||||
| B. | 已知Ksp(AgCl)>Ksp(AgBr),将AgCl和AgBr的饱和溶液等体积混合,再加入足量浓的AgNO3溶液,则最先析出AgBr沉淀并且其沉淀量多于AgCl沉淀 | |||||||||
| C. | 反应A(g)?2B(g)△H若正反应的活化能为Ea kJ•mol-1,逆反应的活化能为Eb kJ•mol-1,则△H=Ea-Eb kJ•mol-1 | |||||||||
| D. | 已知:
|
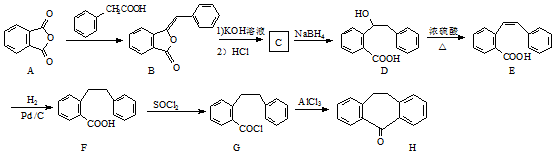
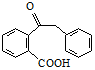 .
.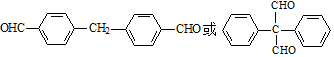 .
.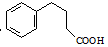 为原料制备
为原料制备 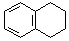 ,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).
,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).