题目内容
10.为达到下表所列的实验目的,所采用的实验方法正确的是( )| 实验目的 | 实验方法 | |
| A | 检验某混合溶液中是否有Cl- | 取样滴加AgNO3溶液 |
| B | 检验氯化铵中的NH4+ | 加热后,用湿润的红色石蕊试纸靠近试管口 |
| C | 鉴别CO2和SO2 | 分别通入澄清石灰水 |
| D | 检验某试液中是否含有SO42- | 取样滴入盐酸酸化后,再滴入BaCl2溶液 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氯化银、硫酸银均为白色沉淀;
B.氯化铵受热易分解生成HCl和氨气,但在试管口氨气和HCl又反应生成氯化铵;
C.二氧化碳和二氧化硫都能和氢氧化钙反应生成白色沉淀;
D.用盐酸酸化的氯化钡溶液检验硫酸根离子,除去亚硫酸根离子等离子的干扰.
解答 解:A.氯化银、硫酸银均为白色沉淀,取样滴加AgNO3溶液,若产生白色沉淀,则不能说明原溶液中含有Cl-,也可能含有硫酸根离子,故A错误;
B.氯化铵受热易分解生成HCl和氨气,但在试管口氨气和HCl又反应生成氯化铵,所以得不到氨气,则不能实现实验目的,故B错误;
C.二氧化碳和二氧化硫都能和氢氧化钙反应生成白色沉淀,现象相同无法鉴别,应该用品红溶液鉴别,二氧化硫能使品红溶液褪色,而二氧化碳不能使品红溶液褪色,故C错误;
D.用盐酸酸化的氯化钡溶液检验硫酸根离子,除去亚硫酸根离子等离子的干扰,所以能实现实验目的,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及物质鉴别、离子检验等知识点,明确实验原理、物质性质及物质性质差异性是解本题关键,注意C中两种气体都能使澄清石灰水变浑浊,为易错点.

练习册系列答案
相关题目
20.某有机物的结构简式为  .下列关于该有机物的叙述不正确的是( )
.下列关于该有机物的叙述不正确的是( )
 .下列关于该有机物的叙述不正确的是( )
.下列关于该有机物的叙述不正确的是( )| A. | 能与金属钠发生反应并放出氢气 | |
| B. | 能在催化剂作用下与H2发生加成反应 | |
| C. | 在浓H2SO4催化下能与乙酸发生酯化反应 | |
| D. | 具有酸性,可以与氢氧化钠溶液反应 |
18.贮存粮食、水果的仓库内可用的保护气是( )
| A. | O2 | B. | N2 | C. | CO2 | D. | H2 |
5.下列化学用语错误的是( )
| A. | 钠的原子结构示意图: | B. | 异丁烷的结构简式: | ||
| C. | 氯化氢的电子式: | D. | 羟基的化学式:OH- |
15.下列各物质间的反应,生成的盐不止一种的是( )
| A. | 氧化铁与稀盐酸 | B. | 铜与浓硫酸 | ||
| C. | 钠在氯气中燃烧 | D. | 氯气通入烧碱溶液 |
2.某科学探究小组为探究电化学原理,设计了如图所示的装置进行探究实验.下列对实验中观察到的现象或有关结论错误的是( )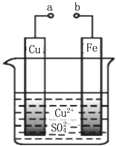

| A. | a和b不连接时,铁片上有红色的铜析出,该装置不能形成原电池 | |
| B. | a和b用导线连接时铜片为负极,发生的反应为:Cu2++2e-═Cu | |
| C. | 无论a和b是否连接,铁片均会被氧化,溶液中均有Fe2+生成 | |
| D. | a和b用导线连接时,溶液中的Cu2+应向铜电极移动 |
3.强酸性溶液X中可能含有Na+、K+、NH4+、Fe2+、Al3+、CO32-、SO42-、Cl-中的若干种,某同学为了确认其成分,取溶液X进行连续实验,实验过程及产物如下:

下列结论正确的是( )

下列结论正确的是( )
| A. | X中肯定存在Na+、NH4+、Fe2+、Al3+、SO42- | |
| B. | 气体F经催化氧化可直接生成气体D | |
| C. | 沉淀C一定是BaSO4、沉淀G一定是Fe(OH)3、沉淀I一定是Al(OH)3 | |
| D. | X中不能确定的离子是Al3+、Na+、K+和Cl- |



 .
. ;
; +
+ →
→ 是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二.
是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二. 无色,无气味并且易燃.是常见的一种化石能源.
无色,无气味并且易燃.是常见的一种化石能源. 有强氧化性的弱酸,见光易分解,具有漂白性,可以用于消毒杀菌.
有强氧化性的弱酸,见光易分解,具有漂白性,可以用于消毒杀菌.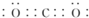 .
.