题目内容
某待测液中可能含有Fe2+、Fe3+、Ag+、Al3+、Ba2+、Ca2+、NH 4+等离子,进行如下实验(所加酸、碱、氨水、溴水都是过量的).
根据实验结果:
(1)写出生成沉淀A的离子方程式
(2)判定待测液中有无Ba2+、Ca2+离子,并写出理由.答: .
(3)写出沉淀D的化学式: .
(4)写出从溶液D生成沉淀E的反应的离子方程式: .

根据实验结果:
(1)写出生成沉淀A的离子方程式
(2)判定待测液中有无Ba2+、Ca2+离子,并写出理由.答:
(3)写出沉淀D的化学式:
(4)写出从溶液D生成沉淀E的反应的离子方程式:
考点:常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题
分析:根据待测液中加入HCl,有不溶于稀硝酸的沉淀A产生,说明待测液中有Ag+存在,沉淀A是AgCl;根据继续往溶液A中加入稀H2SO4和溴水,有沉淀B产生,说明沉淀B一定是不溶于稀酸的硫酸盐沉淀.因为溶液中唯一能与Br-产生沉淀的Ag+已在第一步沉淀完全.所以,溴水的作用应该是起一个氧化剂的作用(氧化某离子),据此,可推断待测液中一定含有Ba2+、Ca2+中的一种或两种,因为BaSO4不溶于水,CaSO4微溶于水(微溶物量大时以沉淀形式存在);根据继续往溶液B中加入氨水,产生沉淀C,沉淀C中加入NaOH溶液,沉淀部分溶解,得溶液D和沉淀D.可知,沉淀D一定是Fe(OH)3(加入溴水后,溶液中就只有Fe3+了.至于原来是Fe2+还是Fe3+,则无法确定).同时,由于往溶液D中通入CO2有沉淀产生,说明溶液D中一定含AlO2-,沉淀E一定是Al(OH)3.然后根据问题回答.
解答:
解:(1)因待测液中加入HCl,有不溶于稀硝酸的沉淀A产生,说明待测液中有Ag+存在,沉淀A是AgCl,离子反应方程式为:Ag++Cl-=AgCl↓,故答案为:Ag++Cl-=AgCl↓;
(2)根据继续往溶液A中加入稀H2SO4和溴水,有沉淀B产生,说明沉淀B一定是不溶于稀酸的硫酸盐沉淀.因为溶液中唯一能与Br-产生沉淀的Ag+已在第一步沉淀完全.所以,溴水的作用应该是起一个氧化剂的作用(氧化某离子),据此,可推断待测液中一定含有Ba2+、Ca2+中的一种或两种,因为BaSO4不溶于水,CaSO4微溶于水(微溶物量大时以沉淀形式存在),故答案为:一定含有Ba2+、Ca2+中的一种或两种;因为BaSO4不溶于水,CaSO4微溶于水,沉淀B一定是这两种物质中的一种或两种;
(3)因继续往溶液B中加入氨水,产生沉淀C,沉淀C中加入NaOH溶液,沉淀部分溶解,得溶液D和沉淀D.可知,沉淀D一定是Fe(OH)3(加入溴水后,溶液中就只有Fe3+了.至于原来是Fe2+还是Fe3+,则无法确定).故答案为:Fe(OH)3;
(4)由于往溶液D中通入CO2有沉淀产生,说明溶液D中一定含AlO2-,沉淀E一定是Al(OH)3,化学方程式为:CO2+3H2O+2AlO2-═2Al(OH)3↓+2CO32-,故答案为:CO2+3H2O+2AlO2-═2Al(OH)3↓+2CO32-.
(2)根据继续往溶液A中加入稀H2SO4和溴水,有沉淀B产生,说明沉淀B一定是不溶于稀酸的硫酸盐沉淀.因为溶液中唯一能与Br-产生沉淀的Ag+已在第一步沉淀完全.所以,溴水的作用应该是起一个氧化剂的作用(氧化某离子),据此,可推断待测液中一定含有Ba2+、Ca2+中的一种或两种,因为BaSO4不溶于水,CaSO4微溶于水(微溶物量大时以沉淀形式存在),故答案为:一定含有Ba2+、Ca2+中的一种或两种;因为BaSO4不溶于水,CaSO4微溶于水,沉淀B一定是这两种物质中的一种或两种;
(3)因继续往溶液B中加入氨水,产生沉淀C,沉淀C中加入NaOH溶液,沉淀部分溶解,得溶液D和沉淀D.可知,沉淀D一定是Fe(OH)3(加入溴水后,溶液中就只有Fe3+了.至于原来是Fe2+还是Fe3+,则无法确定).故答案为:Fe(OH)3;
(4)由于往溶液D中通入CO2有沉淀产生,说明溶液D中一定含AlO2-,沉淀E一定是Al(OH)3,化学方程式为:CO2+3H2O+2AlO2-═2Al(OH)3↓+2CO32-,故答案为:CO2+3H2O+2AlO2-═2Al(OH)3↓+2CO32-.
点评:本题为框图推断题,本题解答时一定要紧扣反应现象及化学反应,推断各离子存在的可能性,属于易错题.

练习册系列答案
相关题目
在氢氧化铁胶体中逐滴滴入下列某种溶液,出现的现象是先沉淀,后沉淀溶解.这种溶液是( )
| A、稀硫酸 |
| B、饱和硫酸镁溶液 |
| C、氢氧化钠溶液 |
| D、饱和硫酸铵溶液 |
 金属钾晶体为体心立方结构(如图所示),则在单位晶胞中钾原子的个数是( )
金属钾晶体为体心立方结构(如图所示),则在单位晶胞中钾原子的个数是( )| A、4 | B、3 | C、2 | D、1 |
工业上用固体硫酸亚铁制取颜料铁红(Fe2O3)反应原理是:2FeSO4
Fe2O3+SO2↑+SO3↑,某学生欲检验该反应所产生的气态物质,依次将气体通过盛有(Ⅰ)BaCl2溶液、(Ⅱ)X溶液、(Ⅲ)NaOH溶液的三个装置.则下列对该方案的评价中正确的是( )
| ||
| A、可将(Ⅰ)中的BaCl2溶液改为Ba(NO3)2溶液 |
| B、(Ⅰ)中会生成BaSO3、BaSO4两种沉淀 |
| C、(Ⅲ)的作用是吸收有毒的SO2气体 |
| D、(Ⅱ)所盛X应为品红溶液 |




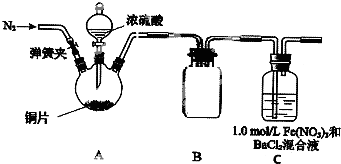 某研究小组探究SO2和Fe(NO3),溶液的反应.
某研究小组探究SO2和Fe(NO3),溶液的反应.