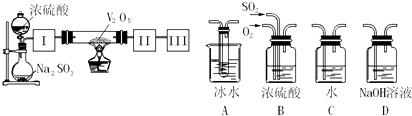
题目内容
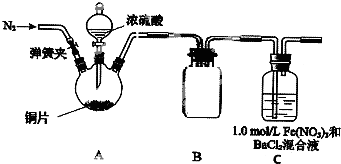 某研究小组探究SO2和Fe(NO3),溶液的反应.
某研究小组探究SO2和Fe(NO3),溶液的反应.已知:1.0mol/L的Fe(NO3)3溶液的pH=l,铁架台等支持仪器已略去,
请回答:
(1)此装置有些不足的地方是
(2)滴加浓硫酸之前要先打开弹簧夹通入一定量的N2,其目的是
(3)装置B的作用是
(4)实验中,装置C中产生了白色沉淀,该沉淀的成分是
(5)分析C中产生白色沉淀的原因:
观点l:SO2与Fe3+反应;
观点2:在酸性条件下SO2与NO-3反应;
观点3:SO2与Fe3+、酸性条件下的NO-3都反应
基于观点1,装置C中反应的离子方程式是
(6)①为证明该观点,请从下列所提供的试剂中,选择适当的试剂
A.KSCN溶液 B.新制的氯水C.酸性KMnO4溶液 D.NaOH溶液
②称取某FeCl2(一部分已被氧化成FeCl3)的样品m克溶于足量的稀硫酸中配成VmL溶液,取V1mL溶液,用cmol/L的①中所选溶液滴定,测出消耗该溶液的体积为V2mL,用m、V、V1、V2、c计算FeCl2的纯度
考点:性质实验方案的设计
专题:
分析:(1)根据铜与浓硫酸反应要加热才能进行,二氧化硫有毒不能直接排到空气中回答;
(2)氧气能将二氧化硫氧化,所以鼓入氮气的目的是排净空气防止干扰实验;
(3)根据二氧化硫的溶解性比较大,应注意防倒吸来回答;
(4)二氧化硫具有还原性,酸性条件下,能被硝酸根离子或铁离子氧化生成硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡白色沉淀;
(5)Fe3+具有氧化性,可将二氧化硫氧化成硫酸根,本身被还原成二价铁,根据反应产物进行书写;
(6)①可通过检验是否有Fe2+生成的方法判断,具体做法为取少量C中溶液于试管中,加入酸性KMnO4溶液如果紫色退去,则溶液中有Fe2+;
②根据酸性KMnO4溶液氧化二价铁的氧化还原方程式中的得失电子守恒结合原子守恒计算出氯化亚铁的质量,再根据纯度=
×100%计算.
(2)氧气能将二氧化硫氧化,所以鼓入氮气的目的是排净空气防止干扰实验;
(3)根据二氧化硫的溶解性比较大,应注意防倒吸来回答;
(4)二氧化硫具有还原性,酸性条件下,能被硝酸根离子或铁离子氧化生成硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡白色沉淀;
(5)Fe3+具有氧化性,可将二氧化硫氧化成硫酸根,本身被还原成二价铁,根据反应产物进行书写;
(6)①可通过检验是否有Fe2+生成的方法判断,具体做法为取少量C中溶液于试管中,加入酸性KMnO4溶液如果紫色退去,则溶液中有Fe2+;
②根据酸性KMnO4溶液氧化二价铁的氧化还原方程式中的得失电子守恒结合原子守恒计算出氯化亚铁的质量,再根据纯度=
| m(FeCl2) |
| m(样品) |
解答:
解:(1)铜与浓硫酸反应要加热才能进行,二氧化硫有毒不能直接排到空气中,所以此装置不足的地方为:A处缺少加热装置;C后面缺少尾气处理装置,
故答案为:A处缺少加热装置;C后面缺少尾气处理装置;
(2)氧气能将二氧化硫氧化,所以如果装置中含有氧气,会干扰实验,所以排入氮气的目的是排净空气防止干扰实验,故答案为:排净装置中的空气,防止溶液中SO2被空气中的O2氧化而干扰实验;
(3)因为二氧化硫的溶解性比较大,所以应注意防倒吸,故装置B的作用是作为安全瓶,防止C中的液体倒吸到A中,故答案为:作为安全瓶,防止C中的液体倒吸到A中;(4)二氧化硫具有还原性,酸性条件下,能被硝酸根离子或铁离子氧化生成硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡白色沉淀,故答案为:BaSO4;
(5)按观点1,装置C中反应的离子方程式是SO2+2Fe3++Ba2++2H2O=BaSO4↓+2Fe2++4H+,故答案为:SO2+2Fe3++Ba2++2H2O=BaSO4↓+2Fe2++4H+;
(6)①可通过检验是否有Fe2+生成的方法判断,具体做法为取少量C中溶液于试管中,加入酸性KMnO4溶液溶液如果紫色退去,则溶液中有Fe2+,故选:C;
②根据得失电子守恒,则氯化铁的物质的量为
×
=
mol,所以FeCl2的纯度=
=
,故答案为:
.
故答案为:A处缺少加热装置;C后面缺少尾气处理装置;
(2)氧气能将二氧化硫氧化,所以如果装置中含有氧气,会干扰实验,所以排入氮气的目的是排净空气防止干扰实验,故答案为:排净装置中的空气,防止溶液中SO2被空气中的O2氧化而干扰实验;
(3)因为二氧化硫的溶解性比较大,所以应注意防倒吸,故装置B的作用是作为安全瓶,防止C中的液体倒吸到A中,故答案为:作为安全瓶,防止C中的液体倒吸到A中;(4)二氧化硫具有还原性,酸性条件下,能被硝酸根离子或铁离子氧化生成硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡白色沉淀,故答案为:BaSO4;
(5)按观点1,装置C中反应的离子方程式是SO2+2Fe3++Ba2++2H2O=BaSO4↓+2Fe2++4H+,故答案为:SO2+2Fe3++Ba2++2H2O=BaSO4↓+2Fe2++4H+;
(6)①可通过检验是否有Fe2+生成的方法判断,具体做法为取少量C中溶液于试管中,加入酸性KMnO4溶液溶液如果紫色退去,则溶液中有Fe2+,故选:C;
②根据得失电子守恒,则氯化铁的物质的量为
| cmol/L×V2×10 -3L×5 |
| 1 |
| V |
| V 1 |
| CVV 2 |
| 200V 1 |
| ||
| mg |
| 127CVV 2 |
| 200V 1m |
| 127CVV 2 |
| 200V 1m |
点评:本题以二氧化硫为载体考查了性质实验方案设计,明确实验原理是解本题关键,根据物质的性质进行假设,然后采用验证的方法进行探究,结合氧化还原反应得失电子守恒法计算分析解答,题目难度中等.

练习册系列答案
相关题目
下列现象或者性质与胶体的性质无关的是( )
| A、同一支钢笔使用不同品牌墨水时,容易发生堵塞现象 |
| B、江河入海口,容易形成沙洲 |
| C、医学上治疗肾衰竭等疾病时,血液的净化手段利用血液透析 |
| D、向氯化铁溶液中加入氢氧化钠溶液,产生红褐色沉淀 |
下列离子方程式正确的是( )
| A、向CaCl2溶液中通入CO2:Ca2++CO2+H2O=CaCO3↓+2H+ |
| B、向NaHSO4溶液逐滴滴加Ba(OH)2溶液至溶液呈中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| C、醋酸和氨水混合:CH3COOH+OH-=CH3COO-+H2O |
| D、石灰石与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O |
某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或两种,现将6.9g样品溶于足量水中,得到澄清溶液,若再加入过量的CaCl2溶液,得到4.5g沉淀,对样品所含杂质的正确判断是( )
| A、肯定有KNO3和Na2CO3,没有Ba(NO3)2 |
| B、肯定有KNO3,没有Ba(NO3)2,可能还有Na2CO3 |
| C、肯定没有Na2CO3和Ba(NO3)2,可能有KNO3 |
| D、以上判断都不正确 |