题目内容
14.氨的合成是最重要的化工生产之一.Ⅰ.工业上合氨用的H2有多种制取的方法:
①用焦炭跟水反应:C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+H2(g);
②用天然气中水蒸气反应:CH4(g)+H2O(g)$\frac{\underline{\;催化剂\;}}{高温}$CO(g)+3H2(g)
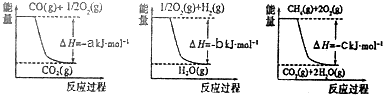
已知有关反应的能量变化如图所示,且方法②的反应只能在高温下发生,则方法②中反应的△H=(a+3b-c)KJ/mol.
Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:
3H2(g)+N2(g)$?_{催化剂}^{高温、高压}$2NH3(g),按不同方式设入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3molH2、2molN2 | 6molH2、4molN2 | 2molNH3 |
| 达到平衡的时间(min) | T | 5 | 8 |
| 平衡时N2的浓度(mol•L-1) | C1 | 3 | |
| N2的体积分数 | ω1 | ω2 | ω3 |
| 混合气体密度(g•L-1) | ρ1 | ρ2 |
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(2)甲容器中达到平衡所需的时间t>5min(填“>”、“<”或“=”).
(3)乙中从反应开始到平衡时N2的平均反应速率0.2mol/(L.min),(注明单位).
(4)分析上表数据,下列关系正确的是c.
a.2c1=3mol/L b.ω1=ω2 c.2ρ1=ρ2
(5)该温度下,容器乙中,该反应的平衡常数K=$\frac{4}{81}$(用分数表示)(mol/L)-2.
Ⅲ.(1)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图1所示.

电池正极的电极反应式是N2+8H++6e-=2NH4+,A是氯化铵.
(2)用氨合成尿素的反应为2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g).工业生产时,原料气带有水蒸气.图2表示CO2的转化率与氨碳比$\frac{n(N{H}_{3})}{n(C{O}_{2})}$、水碳比$\frac{n({H}_{2}O)}{n(C{O}_{2})}$的变化关系.
①曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大是Ⅲ.
②测得B点氨的转化率为40%,则x13.
分析 Ⅰ.由图1、图2、图3可分别得热化学方程式:
①CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H1=-akJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H2=-bkJ•mol-1
③CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H3=-ckJ•mol-1
根据盖斯定律,由③-①-②×3可得:CH4(g)+H2O(g)═CO(g)+3H2(g),则△H=△H3-△H1-3△H2;
Ⅱ.(1)可逆反应到达平衡时,同种物质的正逆反应速率相同,各组分的浓度、含量不变,由此衍生的其它一些物理量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡;
(2)乙等效为在甲基础上压强增大一倍,甲中反应速率比乙中小,故达到平衡所需要的时间更长;
(3)乙容器5min到达平衡,平衡时氮气浓度为3mol/L,计算氮气浓度变化量,再根据v=$\frac{△c}{△t}$计算;
(4)乙等效为在在甲基础上压强增大一倍,平衡正向移动,平衡时乙中反应物转化率比甲中大,平衡时氮气的体积分数减小;
乙中混合气体总质量为甲中2倍,容器容积均为1L,密度之比等于气体质量之比;
(5)计算平衡时各组分浓度,代入平衡常数表达式K=$\frac{{c}^{2}(N{H}_{3})}{{c}^{3}({H}_{2})×c({N}_{2})}$计算;
Ⅲ.(1)正极发生还原反应,由原电池示意图可知,氮气在正极获得电子,酸性条件下生成NH4+,生成的A为氯化铵;
(2)①水碳比$\frac{n({H}_{2}O)}{n(C{O}_{2})}$越大,与有利于平衡逆向进行,平衡时二氧化碳的转化率越小;
②测得B点氨的转化率为40%,二氧化碳转化率为60%,令NH3、CO2起始物质的量分别为amol、bmol,表示出转化的氨气、二氧化碳物质的量,再根据二者按2:1反应计算解答.
解答 解:Ⅰ.由图1、图2、图3可分别得热化学方程式:
①CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H1=-akJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H2=-bkJ•mol-1
③CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H3=-ckJ•mol-1
根据盖斯定律,由③-①-②×3可得:CH4(g)+H2O(g)═CO(g)+3H2(g),则△H=△H3-△H1-3△H2=(a+3b-c)kJ•mol-1,故答案为:(a+3b-c)kJ•mol-1;
Ⅱ.(1)a.容器内N2、H2、NH3的浓度之比为1:3:2,不能说明达到判断状态,取决于起始配料比和转化程度,故a错误;
b.当3v(N2)正=v(H2)逆时,才说明达到平衡状态,故b错误;
c.随反应进行混合气体物质的量进行,恒温恒容下容器内压强减小,但容器内压强保持不变,说明达到平衡状态,故c正确;
d.恒容时体积不变,质量不变,则混合气体的密度保持不变,不能达到平衡状态,故d错误,
故答案为:c;
(2)乙等效为在甲基础上压强增大一倍,甲中反应速率比乙中小,故甲达到平衡所需要的时间更长,即t>5min,故答案为:>;
(3)乙容器5min到达平衡,平衡时氮气浓度为3mol/L,则v(N2)=$\frac{\frac{4mol}{1L}-3mol/L}{5min}$=0.2mol/(L.min),
故答案为:0.2mol/(L.min);
(4)乙等效为在在甲基础上压强增大一倍,平衡正向移动,平衡时乙中反应物转化率比甲中大,平衡时乙中氮气的体积分数比甲中小,则:2c1<3mol/L,ω1>ω2;
乙中混合气体总质量为甲中2倍,容器容积均为1L,密度之比等于气体质量之比,则2ρ1=ρ2,
故选:c;
(5)乙容器5min到达平衡,平衡时氮气浓度为3mol/L,则:
3H2(g)+N2(g)?2NH3(g)
起始量(mol/L):6 4 0
变化量(mol/L):3 1 2
平衡量(mol/L):3 3 2
故平衡常数K=$\frac{{c}^{2}(N{H}_{3})}{{c}^{3}({H}_{2})×c({N}_{2})}$=$\frac{{2}^{2}}{{3}^{3}×3}$=$\frac{4}{81}$,
故答案为:$\frac{4}{81}$;
Ⅲ.(1)正极发生还原反应,由原电池示意图可知,氮气在正极获得电子,酸性条件下生成NH4+,生成的A为氯化铵,正极电极反应式为:N2+8H++6e-=2NH4+,故答案为:N2+8H++6e-=2NH4+;氯化铵;
(2)①水碳比$\frac{n({H}_{2}O)}{n(C{O}_{2})}$越大,与有利于平衡逆向进行,平衡时二氧化碳的转化率越小,故曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大是:Ⅲ,故答案为:Ⅲ;
②测得B点氨的转化率为40%,二氧化碳转化率为60%,令NH3、CO2起始物质的量分别为amol、bmol,则反应的氨气为0.4a,反应的二氧化碳为0.6b,则0.4a:0.6b=2:1,故a:b=3:1,即氨碳比$\frac{n(N{H}_{3})}{n(C{O}_{2})}$的值x1=3,故答案为:3.
点评 本题考查化学平衡计算与影响因素、平衡状态判断、反应速率、平衡常数、反应热计算等,侧重于学生的分析能力和计算能力的考查,难度中等.

 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案| A. | 石灰水和稀盐酸混合 | |
| B. | 小苏打溶液和柠檬水混合 | |
| C. | 人工盐(含有硫酸钠、碳酸氢钠、氯化钠、硫酸钾)溶液与BaCl2溶液混合 | |
| D. | 氯化钠溶液和蔗糖水混合 |
 溴乙烷是一种重要的化工合成原料.实验室合成溴乙烷的反应和实验装置如下:
溴乙烷是一种重要的化工合成原料.实验室合成溴乙烷的反应和实验装置如下:实验中可能用到的数据如表:
| 物 质 | 相对分子质量 | 沸点(℃) | 密度(g•cm-3) | 水溶性 |
| CH3CH2OH | 46 | 78.4 | 0.79 | 互溶 |
| CH3CH2Br | 109 | 38.4 | 1.42 | 难溶 |
| CH3CH2OCH2CH3 | 74 | 34.5 | 0.71 | 微溶 |
| CH2=CH2 | 28 | -103.7 | 0.38 | 不溶 |
| 浓硫酸(H2SO4) | 98 | 338.0 | 1.38 | 易溶 |
②分离提纯:将馏出物加水后振荡,再加入适量酸除去乙醚,分液,最后得到52mL溴乙烷.
回答下列问题:
(1)配制体积比1:1的硫酸所用的定量仪器为b(选填编号).
a.天平 b.量筒 c.容量瓶 d.滴定管
(2)仪器A中发生的反应为:NaBr+H2SO4+CH3CH2CH2CH2OH→CH3CH2CH2CH2Br+NaHSO4+H2O.(用一条方程式表示)
(3)仪器B的名称是蒸馏烧瓶,冷水进口是b(填“a”或“b”).
(4)制备时,需将仪器C置于盛有冰水混合物的烧杯中,目的是冷却溴乙烷.
(5)上述装置中的仪器连接部分都为玻璃接口的原因是:反应会产生Br2,腐蚀橡胶.
(6)溴乙烷粗产品可能混有多种杂质,若仪器A中获得的有机物呈棕黄色,除去其中杂质的正确方法是d(选填编号).
a.蒸馏
b.氢氧化钠溶液洗涤
c.用四氯化碳萃取
d.用亚硫酸钠溶液洗涤
加水的目的是为了除除去溶解在溴乙烷中乙醇.
(7)该实验所得溴乙烷的产率为79%.(保留两位有效数字)
 甲醇与水蒸气反应:CH3OH(g)+H2O$\stackrel{催化剂}{?}$CO2(g)+3H2(g).
甲醇与水蒸气反应:CH3OH(g)+H2O$\stackrel{催化剂}{?}$CO2(g)+3H2(g).(1)在某温度下,测得H2O(g)和CH3OH(g)的浓度随时间变化如表.
| 0min | 10min | 20min | 60min | 70min | |
| c(H2O)/mol•L-1 | 3.00 | 2.80 | 2.65 | 2.50 | 2.50 |
| c(CH3OH)/mol•L-1 | 1.00 | 0.80 | 0.65 | 0.50 | 0.50 |
②平衡时CH3OH的转化率=50%.
③该温度下,此反应的平衡常数K=1.35.
(2)为了探究不同催化剂、温度对化学反应速率的影响,设计了3组实验,所得实验曲线如图所示.
| 实验编号 | T/℃ | c(CH3OH)/mol•L-1 | c(H2O)/mol•L-1 | 催化剂 |
| Ⅰ | 280 | 1.00 | 3.00 | CuO |
| Ⅱ | X | 1.00 | 3.00 | ZrO2 |
| Ⅲ | 380 | Y | Z | ZrO2 |
②以上甲醇与水蒸气反应的△H>0(填“>”、“<”或“=”)
③根据以上探究,该反应的最佳条件是380℃,ZrO2做催化剂.
| A. | 过氧化钠可用于食品、羽毛和织物等的漂白 | |
| B. | 含盐腌制品不宜直接存放在铝制容器中 | |
| C. | 燃放烟花是利用了某些金属元素的焰色反应 | |
| D. | 铝比铁活泼,但铝制品比铁制品在空气中耐腐蚀 |
| A. | 碳酸氢钙溶液中加入少量的氢氧化钠溶液Ca++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| B. | 氯气通入氢氧化钠溶液中:2Cl2+2OH-═3Cl-+ClO-+H2O | |
| C. | 次氯酸钠溶液中通入过量CO2:2ClO-+CO2+H2O═CO32-+2HClO | |
| D. | 氯化亚铁溶液中加入硝酸:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ |
| A. | V=2.24L | |
| B. | 参加反应的HCl为0.18mol | |
| C. | 无法确定最终生成含钾化合物的数量是多少 | |
| D. | 6.32g KMnO4粉末若直接与足量浓盐酸反应可得到2.24L Cl2 |
