题目内容
6.下列离子方程式书写正确的是( )| A. | 碳酸氢钙溶液中加入少量的氢氧化钠溶液Ca++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| B. | 氯气通入氢氧化钠溶液中:2Cl2+2OH-═3Cl-+ClO-+H2O | |
| C. | 次氯酸钠溶液中通入过量CO2:2ClO-+CO2+H2O═CO32-+2HClO | |
| D. | 氯化亚铁溶液中加入硝酸:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ |
分析 A.氢氧化钠少量,反应生成碳酸钙沉淀、碳酸氢钠和水,生成的碳酸根离子完全转化成碳酸钙沉淀;
B.氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;
C.二氧化碳过量,反应生成碳酸氢根离子;
D.亚铁离子被硝酸氧化成铁离子,同时生成一氧化氮气体.
解答 解:A.碳酸氢钙溶液中加入少量的氢氧化钠溶液,反应生成碳酸钙沉淀、碳酸氢钠和水,正确的离子方程式为:Ca++HCO3-+OH-═CaCO3↓+H2O,故A错误;
B.氯气通入氢氧化钠溶液中生成氯化钠、次氯酸钠和水,正确的离子方程式为:Cl2+2OH-═Cl-+ClO-+H2O,故B错误;
C.次氯酸钠溶液中通入过量CO2,反应生成次氯酸和碳酸氢根离子,正确的离子方程式为:ClO-+CO2+H2O═HCO3-+HClO,故C错误;
D.氯化亚铁溶液中加入硝酸,二者发生氧化还原反应,反应的离子方程式为:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑,故D正确;
故选D.
点评 本题考查了离子方程式的判断,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法,如:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
相关题目
1.下列物质能将品红氧化使品红溶液褪色的是( )
①活性炭 ②过氧化钠 ③氯水 ④二氧化硫 ⑤臭氧.
①活性炭 ②过氧化钠 ③氯水 ④二氧化硫 ⑤臭氧.
| A. | ①②③④⑤ | B. | ②③④⑤ | C. | ②③④ | D. | ②③⑤ |
14.氨的合成是最重要的化工生产之一.
Ⅰ.工业上合氨用的H2有多种制取的方法:
①用焦炭跟水反应:C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+H2(g);
②用天然气中水蒸气反应:CH4(g)+H2O(g)$\frac{\underline{\;催化剂\;}}{高温}$CO(g)+3H2(g)
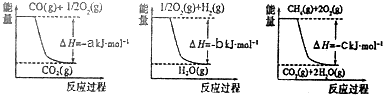
已知有关反应的能量变化如图所示,且方法②的反应只能在高温下发生,则方法②中反应的△H=(a+3b-c)KJ/mol.
Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:
3H2(g)+N2(g)$?_{催化剂}^{高温、高压}$2NH3(g),按不同方式设入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
(1)下列能说明该反应已达到平衡状态的是c.
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(2)甲容器中达到平衡所需的时间t>5min(填“>”、“<”或“=”).
(3)乙中从反应开始到平衡时N2的平均反应速率0.2mol/(L.min),(注明单位).
(4)分析上表数据,下列关系正确的是c.
a.2c1=3mol/L b.ω1=ω2 c.2ρ1=ρ2
(5)该温度下,容器乙中,该反应的平衡常数K=$\frac{4}{81}$(用分数表示)(mol/L)-2.
Ⅲ.(1)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图1所示.

电池正极的电极反应式是N2+8H++6e-=2NH4+,A是氯化铵.
(2)用氨合成尿素的反应为2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g).工业生产时,原料气带有水蒸气.图2表示CO2的转化率与氨碳比$\frac{n(N{H}_{3})}{n(C{O}_{2})}$、水碳比$\frac{n({H}_{2}O)}{n(C{O}_{2})}$的变化关系.
①曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大是Ⅲ.
②测得B点氨的转化率为40%,则x13.
Ⅰ.工业上合氨用的H2有多种制取的方法:
①用焦炭跟水反应:C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+H2(g);
②用天然气中水蒸气反应:CH4(g)+H2O(g)$\frac{\underline{\;催化剂\;}}{高温}$CO(g)+3H2(g)
已知有关反应的能量变化如图所示,且方法②的反应只能在高温下发生,则方法②中反应的△H=(a+3b-c)KJ/mol.

Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:
3H2(g)+N2(g)$?_{催化剂}^{高温、高压}$2NH3(g),按不同方式设入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3molH2、2molN2 | 6molH2、4molN2 | 2molNH3 |
| 达到平衡的时间(min) | T | 5 | 8 |
| 平衡时N2的浓度(mol•L-1) | C1 | 3 | |
| N2的体积分数 | ω1 | ω2 | ω3 |
| 混合气体密度(g•L-1) | ρ1 | ρ2 |
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(2)甲容器中达到平衡所需的时间t>5min(填“>”、“<”或“=”).
(3)乙中从反应开始到平衡时N2的平均反应速率0.2mol/(L.min),(注明单位).
(4)分析上表数据,下列关系正确的是c.
a.2c1=3mol/L b.ω1=ω2 c.2ρ1=ρ2
(5)该温度下,容器乙中,该反应的平衡常数K=$\frac{4}{81}$(用分数表示)(mol/L)-2.
Ⅲ.(1)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图1所示.

电池正极的电极反应式是N2+8H++6e-=2NH4+,A是氯化铵.
(2)用氨合成尿素的反应为2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g).工业生产时,原料气带有水蒸气.图2表示CO2的转化率与氨碳比$\frac{n(N{H}_{3})}{n(C{O}_{2})}$、水碳比$\frac{n({H}_{2}O)}{n(C{O}_{2})}$的变化关系.
①曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大是Ⅲ.
②测得B点氨的转化率为40%,则x13.
1.使用容量瓶配制溶液时,由于操作不当,会引起误差,下列情况会使所配溶液浓度偏
低的是( )
①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了
②溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
③转移溶液前容量瓶内有少量蒸馏水
④定容时,俯视容量瓶的刻度线
⑤定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线.
低的是( )
①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了
②溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
③转移溶液前容量瓶内有少量蒸馏水
④定容时,俯视容量瓶的刻度线
⑤定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线.
| A. | ①②⑤ | B. | ①③⑤ | C. | ③④⑤ | D. | ②③④ |
11.在一定温度下,在容积恒定的密闭容器中发生反应:2A(s)+2B(g)?C(g)+D(g)当下列物理量不发生变化时,能说明该反应已达到平衡状态的是( )
①混合气体平均相对分子质量 ②容器内气体压强 ③混合气体总物质的量 ④C物质的量浓度.
①混合气体平均相对分子质量 ②容器内气体压强 ③混合气体总物质的量 ④C物质的量浓度.
| A. | 只有②③ | B. | ①④ | C. | ②③④ | D. | 只有④ |
18.运用有关概念,判断下列叙述正确的是( )
| A. | CO2溶于水后能导电,故CO2为电解质 | |
| B. | H216O、D216O、H218O、D218O互为同素异形体 | |
| C. | NaCl溶液和CH3COONH4溶液均显中性,故两溶液中水的电离程度相同 | |
| D. | 溶液与胶体本质区别为分散质微粒直径的大小不同 |
15.下列仪器中,不能直接用于加热的是( )
| A. | 烧杯 | B. | 坩埚 | C. | 蒸发皿 | D. | 试管 |
16.下列反应中只能生成一种有机物的是( )
| A. | 甲烷和氯气混合光照发生取代反应 | |
| B. | 2-戊烯通入酸性高锰酸钾溶液发生氧化反应 | |
| C. | 乙烯和氯化氢发生加成反应 | |
| D. | 丙烯和氯化氢发生加成反应 |