题目内容
11.常温下,下列溶液中离子浓度关系表达正确的是( )| A. | Na2CO3溶液中:c(H+)+c(Na+)=c(OH-)+c(CO32-)+c(HCO3-) | |
| B. | 0.1mol/L的Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-) | |
| C. | pH=5.3的NaHSO3溶液:c(Na+)>c(HSO3-)>c(H2SO3)>c(SO32-) | |
| D. | pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后:c(Na+)>c(CH3COO-)+c(OH-)+c(H+) |
分析 A.电解质溶液中存在电荷守恒,阴阳离子所带电荷数相同;
B.碳酸钠溶液中碳酸根离子分步水解,溶液显碱性;
C.pH=5.3的NaHSO3溶液显酸性,HSO3-电离程度大于其水解程度;
D.pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后,醋酸是弱酸存在电离平衡,反应后醋酸又电离溶液显酸性,溶液中存在电荷守恒;
解答 解:A.电解质溶液中存在电荷守恒,阴阳离子所带电荷数相同,Na2CO3溶液中电荷守恒:c(H+)+c(Na+)=c(OH-)+2(CO32-)+c(HCO3-),故A错误;
B.碳酸钠溶液中碳酸根离子分步水解,溶液显碱性,0.1mol/L的Na2CO3溶液中离子浓度大小为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),故B正确;
C.pH=5.3的NaHSO3溶液显酸性,HSO3-电离程度大于其水解程度,离子浓度大小为c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3),故C错误;
D.PH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后,醋酸是弱酸存在电离平衡,反应后醋酸又电离溶液显酸性,溶液中电荷守恒,c(Na+)+c(H+)=c(CH3COO-)+c(OH-),c(Na+)<c(CH3COO-)+c(OH-)+c(H+),故D错误;
故选B.
点评 本题考查了盐类水解、电解质溶液中离子浓度大小比较,溶液中电荷守恒等知识,题目难度中等.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
1.等物质的量的氢气和氨气在同温同压下具有相等的( )
| A. | 原子数 | B. | 体积 | C. | 质子数 | D. | 质量 |
2.在浓盐酸中H3AsO3与SnCl2反应的离子方程式为3SnCl2+12Cl-+2H3AsO3+6H+═2As+3SnCl62-+6M,关于该反应的说法中不正确的是( )
| A. | M为H2O | |
| B. | SnCl62-是氧化产物 | |
| C. | 还原性:As>SnCl2 | |
| D. | 每生成1molAs,反应中转移电子的物质的量为3mol |
19.下列反应的离子方程式书写正确的是( )
| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 向Al2(SO4)3溶液中加入过量NH3?H2O:Al3++4NH3?H2O═AlO2-+4NH4++2H2O | |
| C. | 酸性溶液中KClO3与KCl反应生成Cl2:ClO3-+Cl-+6H+═Cl2↑+3H2O | |
| D. | 向含1molNaHSO3的溶液中加入1molNa2O2:Na2O2+HSO3-═2Na++SO42-+OH- |
6.已知4NH3(g)+5O2(g)═4NO(g)+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列关系正确的是( )
| A. | 4 v(NH3)=5 v(O2) | B. | 5v(O2)=6 v(H2O) | C. | 2 v(NH3)=3 v(H2O) | D. | 4v(O2)=5 v(NO) |
16.如图是某同学设计的验证原电池和电解池的实验装置,下列说法不正确的是( )
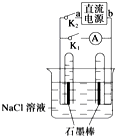

| A. | 若关闭K2、打开K1,一段时间后,发现左侧试管收集到的气体比右侧略多,则a为正极,b为负极 | |
| B. | 关闭K2,打开K1,一段时间后,用拇指堵住试管移出烧 杯,向试管内滴入酚酞,发现左侧试管内溶液变红色,则 a为负极,b为正极 | |
| C. | 若直流电源a为负极,b为正极,关闭K2,打开K1,一段时间后,再关闭K1,打开K2,则电路中电流方向为从右侧石墨棒沿导线到左侧石墨棒 | |
| D. | 若直流电源a为负极,b为正极,关闭K2,打开K1,一段时间后,再关闭K1,打开K2,则左侧石墨棒上发生的电极反应为H2-2e-+2OH-═2H2O |
3.巴黎气候大会揭开了发展低碳经济的宏伟序幕,下列有关说法正确的是( )


| A. | 太阳能、地热能、核能、化石燃料等均属于“新能源” | |
| B. | 减少含碳物质做燃料符合“低碳”理念 | |
| C. | 图中转化途径不能体现“节能减排”的思想 | |
| D. | 节约用电不能减少CO2的排放量 |
20.在101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热,甲烷的燃烧热是890.3kJ•mol-1,则下列热化学方程式书写正确的是( )
| A. | CH4(g)+$\frac{3}{2}$O2(g)═CO(g)+2H2O(l)△H=-890.3kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890.3kJ•mol-1 | |
| D. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ•mol-1 |