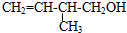题目内容
19.下列叙述正确的是( )| A. | 强电解质溶液的导电能力一定比弱电解质溶液强 | |
| B. | 用相同的盐酸中和体积,物质的量浓度均相同的氢氧化钠和氨水溶液,所需盐酸的量相等 | |
| C. | 将氢氧化钠和氨水溶液各稀释一倍,两者的OH-浓度均减少到原来的50% | |
| D. | 氢氧化钠溶液的物质的量浓度是氨水的两倍,则氢氧化钠的OH-浓度也是氨水溶液的两倍 |
分析 A、溶液导电能力由溶液中离子浓度大小决定,与电解质强弱无关;
B.等体积、等物质的量浓度的盐酸和醋酸溶液,溶质的物质的量相等;
C.一水合氨为弱电解质,加水促进电离;
D.氢氧化钠是强碱完全电离,而氨水是弱碱部分电离.
解答 解:A、溶液导电能力由溶液中离子浓度大小决定,与电解质强弱无关,故A错误;
B.等体积、等物质的量浓度的盐酸和醋酸溶液,溶质的物质的量相等,消耗氢氧化钠一样多,故B正确;
C.一水合氨为弱电解质,加水促进电离,将氢氧化钠溶液和氨水溶液各稀释一倍,氨水的OH-浓度大于原来的50%,故C错误;
D.氢氧化钠是强碱完全电离,而氨水是弱碱部分电离,所以则氢氧化钠的OH-浓度比氨水溶液氢氧根离子浓度的两倍大,故D错误;
故选B.
点评 本题考查弱电解质的电离,难度不大,注意概念的区分,能否导电与是否强、弱电解质无关系.

练习册系列答案
相关题目
7.常用特定图案来表示危险化学品的类别.下列组合中图案与化学品性质相符的是( )
| A. |  酒精 | B. |  浓盐酸 | C. |  浓硫酸 | D. |  CO2 |
10.等质量的SO2和SO3相比较,下列正确的是( )
| A. | 它们的分子数目之比为1:1 | B. | 它们的氧原子数目之比为4:5 | ||
| C. | 它们的体积之比为5:4 | D. | 它们所含的硫原子数之比为5:4 |
14.某有机物完全燃烧时只生成水和二氧化碳,且两者的物质的量之比为3:2,因而可以说( )
| A. | 该有机物含碳、氢、氧三种元素 | |
| B. | 该化合物是乙烷 | |
| C. | 该化合物分子中碳、氢原子个数之比是1:3 | |
| D. | 该化合物分子中含2个碳原子,6个氢原子,但不能确定是否含氧分子 |
4.某温度时,N2+3H2?2NH3的平衡常数K=a,则此温度下,NH3?$\frac{3}{2}$H2+$\frac{1}{2}$N2的平衡常数为( )
| A. | a${\;}^{-\frac{1}{2}}$ | B. | a${\;}^{\frac{1}{2}}$ | C. | a2 | D. | aˉ2 |
11.化学概念在逻辑上存在如图所示关系:对下列概念的说法正确的是( )


| A. | 纯净物与混合物属于包含关系 | |
| B. | 化合物与单质属于包含关系 | |
| C. | 金属氧化物与酸性氧化物属于交叉关系 | |
| D. | 电解质与非金属氧化物属于并列关系 |