题目内容
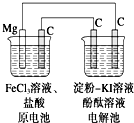 某研究性学习小组的课题为“MgC原电池电解淀粉KI溶液的研究”,其研究装置如图所示.下列有关说法不正确的是( )
某研究性学习小组的课题为“MgC原电池电解淀粉KI溶液的研究”,其研究装置如图所示.下列有关说法不正确的是( )| A、镁为负极,发生还原反应 |
| B、原电池中碳极反应式为Fe3++e-═Fe2+ |
| C、电解池中阳极处变蓝 |
| D、电解池中阴极处变红 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:原电池中镁为负极,发生氧化反应,电极方程式为Mg-2e-=Mg2+,正极发生还原反应,电极方程式为Fe3++e-=Fe2+,电解KI溶液时,阳极发生氧化反应,电极方程式为2I--2e-=I2,阴极发生还原反应,电极方程式为2H++2e-═H2↑,以此解答该题.
解答:
解:A.原电池中镁为负极,发生氧化反应,故A错误;
B.左边原电池中碳为正极,正极发生还原反应,电极方程式为Fe3++e-=Fe2+,故B正确;
C.电解KI溶液时,阳极生成碘,则阳极处变蓝,故C正确;
D.阴极氢离子得电子发生还原反应生成氢气,同时氢氧根离子,所以阴极处变红色,故D正确.
故选A.
B.左边原电池中碳为正极,正极发生还原反应,电极方程式为Fe3++e-=Fe2+,故B正确;
C.电解KI溶液时,阳极生成碘,则阳极处变蓝,故C正确;
D.阴极氢离子得电子发生还原反应生成氢气,同时氢氧根离子,所以阴极处变红色,故D正确.
故选A.
点评:本题综合考查电解池和原电池知识,侧重于学生的分析能力的考查,注意把握原电池和电解池的工作原理,难度不大.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
下列说法正确的是( )
| A、葡萄糖、蔗糖、淀粉均是糖类,均可发生水解反应 |
| B、往氯乙烷溶液中滴加AgNO3溶液可产生白色沉淀 |
| C、蛋白质溶液中加入浓的硫酸钠溶液会有沉淀析出 |
| D、石油经裂化得到的汽油可用来萃取溴水中的Br2 |
下列的方程式正确的是( )
| A、K2C2O4溶液的电离方程式:K2C2O4?2K++C2O42- |
| B、制备乙酸乙酯时将产生的蒸气导入饱和碳酸钠溶液:CO32ˉ+2H+=CO2↑+H2O |
| C、氯化镁溶液中通入二氧化碳:Mg2++CO2+H2O═MgCO3↓+2H+ |
| D、将等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O |
相同质量的下列物质分别与足量的AgNO3溶液反应,生成沉淀最多的是( )
| A、NaCl |
| B、CaCl2 |
| C、FeCl2 |
| D、ZnCl2 |
相同条件下22克下列气体中跟22克二氧化碳的体积相等的是( )
| A、SO2 |
| B、N2 |
| C、N2O |
| D、CO |
反应4A(g)+3B(g)═2C(g)+D(g),2min后,B的浓度减小了0.6mol/L,下列反应速率的表示不正确的是( )
| A、用B表示的反应速率是0.3 mol/L?min |
| B、用A表示的反应速率是0.4 mol/L?min |
| C、0.3 mol/L?min是B在2min末的瞬时速率 |
| D、用D表示的反应速率是0.1 mol/L?min |
下列有关实验的叙述正确的是( )
| A、浓硝酸可保存在带橡皮塞的棕色细口瓶中 |
| B、用pH试纸测定溶液pH时,pH试纸应事先润湿 |
| C、配制一定物质的量浓度的溶液时,选用的容量瓶规格由需配制的溶液体积决定 |
| D、中和滴定时,为了使滴定终点溶液颜色变化明显,可多滴几滴指示剂 |
 下表各组物质中,满足如图物质一步转化关系的选项是
下表各组物质中,满足如图物质一步转化关系的选项是