题目内容
相同质量的下列物质分别与足量的AgNO3溶液反应,生成沉淀最多的是( )
| A、NaCl |
| B、CaCl2 |
| C、FeCl2 |
| D、ZnCl2 |
考点:化学方程式的有关计算
专题:计算题
分析:均发生反应:Ag++Cl-=AgCl↓,相同质量的电解质含有氯离子的质量分数越大,则生成AgCl越多.
解答:
解:均发生反应:Ag++Cl-=AgCl↓,相同质量的电解质含有氯离子的质量分数越大,则生成AgCl越多:
A.NaCl中Na与Cl元素质量之比=23:35.5,
B.CaCl2中Ca与Cl元素质量之比=40:35.5×2=20:35.5,
C.FeCl2中Fe与Cl元素质量之比=56:35.5×2=28:35.5,
D.ZnCl2中Ca与Cl元素质量之比=65:35.5×2=32.5:35.5,
故CaCl2中-1价氯元素质量分数最大,则等质量各物质中CaCl2反应生成AgCl的质量最大,
故选B.
A.NaCl中Na与Cl元素质量之比=23:35.5,
B.CaCl2中Ca与Cl元素质量之比=40:35.5×2=20:35.5,
C.FeCl2中Fe与Cl元素质量之比=56:35.5×2=28:35.5,
D.ZnCl2中Ca与Cl元素质量之比=65:35.5×2=32.5:35.5,
故CaCl2中-1价氯元素质量分数最大,则等质量各物质中CaCl2反应生成AgCl的质量最大,
故选B.
点评:本题考查化学方程式的计算,注意利用离子方程式判断:相同质量的电解质含有氯离子的质量分数越大,则生成AgCl越多,难度不大.

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案
相关题目
下列仪器中,没有“0”刻度线的是( )
| A、温度计 | B、托盘天平 |
| C、容量瓶 | D、滴定管 |
电浮选凝聚法处理酸性污水的工作原理如图.下列说法正确的是( )


| A、为增强污水的导电能力,可向污水中加入适量工业用食盐 |
| B、通入甲烷气体的电极反应式为:CH4-8e-+10OH-=CO32-+7H2O |
| C、若左池石墨电极产生22.4L气体,则消耗0.25 mol甲烷 |
| D、铁电极的电极反应式为:Fe-3e-=Fe3+ |
化学知识在生活中有重要意义,下列说法不正确的是( )
| A、在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 |
| B、乙醇、乙酸和甲醛广泛应用于食品加工 |
| C、计算机芯片所用的材料是高纯度的二氧化硅 |
| D、捕获工业排放的CO2能降低地球的温室效应 |
下列说法正确的是( )
| A、6.02×1023个碳原子的质量为1g |
| B、钠原子的摩尔质量为23g |
| C、1molHCl的体积是22.4L |
| D、CO2的摩尔质量为44g?mol-1 |
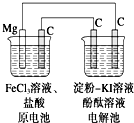 某研究性学习小组的课题为“MgC原电池电解淀粉KI溶液的研究”,其研究装置如图所示.下列有关说法不正确的是( )
某研究性学习小组的课题为“MgC原电池电解淀粉KI溶液的研究”,其研究装置如图所示.下列有关说法不正确的是( )| A、镁为负极,发生还原反应 |
| B、原电池中碳极反应式为Fe3++e-═Fe2+ |
| C、电解池中阳极处变蓝 |
| D、电解池中阴极处变红 |
下列说法正确的是( )
| A、氧的摩尔质量是32 g?mol-1 |
| B、CO32-摩尔质量是60 g/mol |
| C、CO2的相对分子质量是44g |
| D、硫酸的摩尔质量是98g |
下列说法正确的是( )
A、
| ||||||||||
| B、11.7g食盐晶体中的分子数为0.2×6.02×10-23 | ||||||||||
| C、等量的白磷蒸气和白磷固体分别完全燃烧,后者放出热量多 | ||||||||||
| D、根据分散系的稳定性大小将混合物分为胶体、溶液和浊液 |
 (1)材料是人类赖以生存和发展的重要物质基础.
(1)材料是人类赖以生存和发展的重要物质基础.